
6.(全国I理综第10题,6分)用0.10
mol·L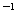 的盐酸滴定0.10 mol·L
的盐酸滴定0.10 mol·L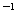 的氨水,滴定过程中不可能出现的结果是
的氨水,滴定过程中不可能出现的结果是
A.c(NH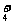 ) >c(Cl-) ,c(OH-)
> c(H+) B. c(NH
) >c(Cl-) ,c(OH-)
> c(H+) B. c(NH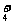 ) = c(Cl-) ,c(OH-)
= c(H+)。
) = c(Cl-) ,c(OH-)
= c(H+)。
C.c(Cl-)>c(NH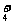 ) ,c(OH-) > c(H+) D. c(Cl-)>c(NH
) ,c(OH-) > c(H+) D. c(Cl-)>c(NH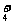 ) ,c(H+)>c(OH-)
) ,c(H+)>c(OH-)
5. 答案B
答案B
 详解:A项氯化铵为强电解质完全电离后产生大量的NH4+;氨水为弱电解质只有少量的NH4+产生。B项在水中加入酸和碱都抑制水的电离,盐酸是强酸抑制水的电离的程度大,B项不正确。①和②等体积混合后的溶液恰好是氯化铵溶液,溶剂守恒式:c(H+)=c(OH
详解:A项氯化铵为强电解质完全电离后产生大量的NH4+;氨水为弱电解质只有少量的NH4+产生。B项在水中加入酸和碱都抑制水的电离,盐酸是强酸抑制水的电离的程度大,B项不正确。①和②等体积混合后的溶液恰好是氯化铵溶液,溶剂守恒式:c(H+)=c(OH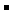 )+c(NH3·H2O),C正确;①和③等体积混合后的溶液形成的是pH>7的缓冲溶液,以氨水的电离为主,D选项正确。
)+c(NH3·H2O),C正确;①和③等体积混合后的溶液形成的是pH>7的缓冲溶液,以氨水的电离为主,D选项正确。
 要点1:浓度相同的氨水和氯化铵溶液,氯化铵溶液中的c(NH+4)大;浓度相同的醋酸溶液和醋酸钠溶液,醋酸钠溶液中的c(CH3COO-)大。
要点1:浓度相同的氨水和氯化铵溶液,氯化铵溶液中的c(NH+4)大;浓度相同的醋酸溶液和醋酸钠溶液,醋酸钠溶液中的c(CH3COO-)大。
要点2:相同温度下,同浓度同元数的强酸溶液比弱酸溶液更能抑制水的电离,强酸溶液中水电离出来的氢离子浓度更小。
要点3:氯化铵溶液中的三守恒一大小关系:
(1)溶质守恒:c(Cl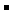 )=
c(NH
)=
c(NH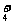 )+ c(NH3·H2O)
)+ c(NH3·H2O)
(2)溶剂守恒:c(H+)=c(OH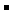 )+c(NH3·H2O)
)+c(NH3·H2O)
(3)电荷守恒:c(NH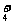 ) +c(H+)=c(Cl
) +c(H+)=c(Cl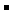 )+c(OH
)+c(OH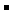 )
)
(4)大小关系:c(Cl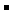 )>c(NH
)>c(NH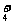 )>c(H+)>c(OH
)>c(H+)>c(OH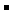 )
)
-----------------------------------------------------------------------------------------------------------------------------------------
5. (四川理综卷第12题)关于浓度均为0.1
mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是
(四川理综卷第12题)关于浓度均为0.1
mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是

 A. c(NH
A. c(NH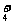 ):③>①
):③>①
 B.水电离出的c(H+):②>①
B.水电离出的c(H+):②>①
 C.①和②等体积混合后的溶液:c(H+)=c(OH
C.①和②等体积混合后的溶液:c(H+)=c(OH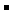 )+c(NH3·H2O)
)+c(NH3·H2O)
 D.①和③等体积混合后的溶液:c(NH
D.①和③等体积混合后的溶液:c(NH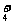 )>c(Cl
)>c(Cl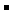 )>c(OH
)>c(OH )>c(H+)
)>c(H+)
4.答案:A
详解:由表中数据可知,H2CO3的酸性大于HClO,HClO的酸性大于HCO3-的酸性,则ClO-的水解程度大于HCO3-,c(HCO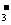 )>c(ClO-),溶质离子浓度大于溶剂离子浓度,NaClO、NaHCO3溶液水解呈碱性c(HCO
)>c(ClO-),溶质离子浓度大于溶剂离子浓度,NaClO、NaHCO3溶液水解呈碱性c(HCO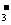 )>c(ClO-)>c(OH-)>c(H+)故A项正确, B项错误。根据物料守恒:c(HClO)+c(ClO-)=
c(HCO
)>c(ClO-)>c(OH-)>c(H+)故A项正确, B项错误。根据物料守恒:c(HClO)+c(ClO-)=
c(HCO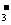 )+c(H2CO3)+c(CO
)+c(H2CO3)+c(CO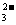 ),C错误;根据电荷守恒:c(Na+)+c(H+)=
c(HCO
),C错误;根据电荷守恒:c(Na+)+c(H+)=
c(HCO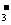 )+c(ClO-)+c(OH-)+2 c(CO
)+c(ClO-)+c(OH-)+2 c(CO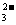 )
)
D选项错误。
4.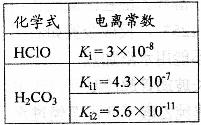
 (上海化学卷第17题)根据右表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是
(上海化学卷第17题)根据右表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是
 A.c(HCO
A.c(HCO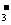 )>c(ClO-)>c(OH-)
)>c(ClO-)>c(OH-)
 B.c(ClO-)>c(HCO
B.c(ClO-)>c(HCO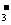 )>c(H+)
)>c(H+)
 C.c(HClO)+c(ClO-)=
c(HCO
C.c(HClO)+c(ClO-)=
c(HCO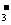 )+c(H2CO3)
)+c(H2CO3)
 D.c(Na+)+c(H+)=
c(HCO
D.c(Na+)+c(H+)=
c(HCO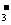 )+c(ClO-)+c(OH-)
)+c(ClO-)+c(OH-)
3.答案:B
详解:A项中由于两种酸的浓度不知,无法比较pH大小,故错误。C项没有限定是饱和溶液,C项也错误。单质还原性强弱与失电子难易有关,与数目没有必然关系, 故D错误。
3. (上海化学卷第14题)根据以下事实得出的判断一定正确的是
(上海化学卷第14题)根据以下事实得出的判断一定正确的是

 A.HA的酸性比HB的强,则HA溶液 pH比HB溶液的小
A.HA的酸性比HB的强,则HA溶液 pH比HB溶液的小
 B.
B.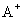 和
和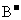 的电子层结构相同,则A原子的核电荷数比B原子的大
的电子层结构相同,则A原子的核电荷数比B原子的大
 C.A盐的溶解度在同温下比B盐的大,则A盐溶液的溶质质量分数比B盐溶液的大
C.A盐的溶解度在同温下比B盐的大,则A盐溶液的溶质质量分数比B盐溶液的大
 D.A原子失去的电子比B原子的多,则A单质的还原性比B单质的强
D.A原子失去的电子比B原子的多,则A单质的还原性比B单质的强
2. 答案:D
答案:D
 [详解]A选项氢氧化钠和醋酸发生中和反应,反应放热,当酸反应完成后,再加碱,相当于往热水中加入冷水,温度降低,A正确。B选项醋酸中滴加氢氧化钠酸性减弱pH增大。C选项醋酸中滴加氢氧化钠,相当于弱电解质溶液变成强电解质溶液,因此导电能力增加。D选项醋酸中滴加氢氧化钠,即便醋酸完全反应,醋酸钠还是有微弱的水解,醋酸的浓度不可能为0,D错误。
[详解]A选项氢氧化钠和醋酸发生中和反应,反应放热,当酸反应完成后,再加碱,相当于往热水中加入冷水,温度降低,A正确。B选项醋酸中滴加氢氧化钠酸性减弱pH增大。C选项醋酸中滴加氢氧化钠,相当于弱电解质溶液变成强电解质溶液,因此导电能力增加。D选项醋酸中滴加氢氧化钠,即便醋酸完全反应,醋酸钠还是有微弱的水解,醋酸的浓度不可能为0,D错误。
 [要点1]酸碱中和反应是放热反应。
[要点1]酸碱中和反应是放热反应。
[要点2]醋酸中加入氢氧化钠导电性增强,氨水中加入强酸导电性增强,硫酸中滴入氢氧化钡溶液导电性逐渐减弱,到最弱后,再逐渐增强。
[要点3]强碱弱酸盐溶液中一定有弱酸分子存在,强酸弱碱盐溶液中也一定有弱碱存在,只不过量少而已。
1.答案:B
详解:0.1mo1/L某一元酸HA在水中有0.1%发生电离,说明HA是弱酸,其电离方程式为HA H+
+A- ;
H+
+A- ;
c(H+)=c(HA)·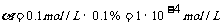 ,pH=-lg{c(H+)}=4,A不符合题意;HA是弱酸,弱酸的电离是吸热的,升温促进电离,电离度
,pH=-lg{c(H+)}=4,A不符合题意;HA是弱酸,弱酸的电离是吸热的,升温促进电离,电离度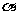 增大,c(H+)随之增大,lg{c(H+)}也增大,-lg{c(H+)}减小,pH减小,B符合题意;电离平衡时c(A-)=
c(H+)=
增大,c(H+)随之增大,lg{c(H+)}也增大,-lg{c(H+)}减小,pH减小,B符合题意;电离平衡时c(A-)=
c(H+)=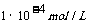 ,c(HA)=0.1mol/L-
,c(HA)=0.1mol/L-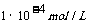 ≈0.1mol/L;
≈0.1mol/L;
此酸的电离平衡常数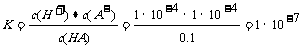 ,C不符合题意;酸的存在抑制了水的电离,使得水电离出来的c(H+)=c(OH-)远小于1
,C不符合题意;酸的存在抑制了水的电离,使得水电离出来的c(H+)=c(OH-)远小于1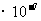 mol/L,酸电离出来的c(H+)=
mol/L,酸电离出来的c(H+)=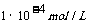 远大于水电里出来的c(H+),溶液中的c(H+)可以忽略水电离出来的c(H+);溶液中的c(H+)=
远大于水电里出来的c(H+),溶液中的c(H+)可以忽略水电离出来的c(H+);溶液中的c(H+)=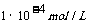 ,
,
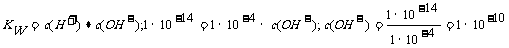 ,水电离出来的c(H+)=c(OH-)=1
,水电离出来的c(H+)=c(OH-)=1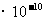 ,由HA电离出的c(H+)约为水电离出的c(H+)的106倍,D不符合题意。
,由HA电离出的c(H+)约为水电离出的c(H+)的106倍,D不符合题意。
要点1:一元弱酸的电离方程式为HA H+
+A- ;溶液中的c(H+)=c(HA)·
H+
+A- ;溶液中的c(H+)=c(HA)·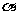 ;溶液的pH= - lg {c(H+)}
;溶液的pH= - lg {c(H+)}
要点2:一元弱酸的电离方程式为HA H+
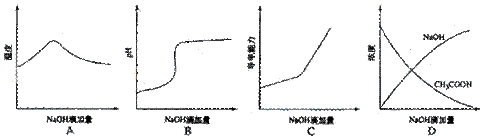
+A-,此酸的电离平衡常数
H+
+A-,此酸的电离平衡常数
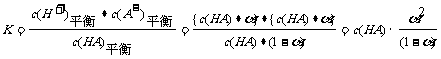
 要点3:一元弱酸的电离方程式为HA
要点3:一元弱酸的电离方程式为HA H+
+A-,由HA电离出的c(H+)约为水电离出的c(H+)的倍数关系:
H+
+A-,由HA电离出的c(H+)约为水电离出的c(H+)的倍数关系: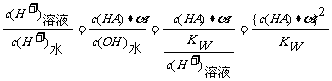 2
2 。(宁夏理综卷第11题)将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶液有关量或性质的变化趋势,其中错误的是
。(宁夏理综卷第11题)将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶液有关量或性质的变化趋势,其中错误的是

1.(海南化学卷第6题,3分)已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是
A.该溶液的pH=4 B.升高温度,溶液的pH增大
C.此酸的电离平衡常数约为1×10-7 D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com