
16. (广东化学卷第9题,3分)下列浓度关系正确的是
(广东化学卷第9题,3分)下列浓度关系正确的是
A.氯水中:c(Cl2)=2[c(ClO-)+c(Cl-)+C(HClO)]
B.氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-)
C.等体积等浓度的氢氧化钠与醋酸混合:c(Na+)=c(CH3COO-)

D.Na2CO3溶液中:c(Na+)>c(CO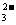 )
) >c(OH-)> c(HCO
>c(OH-)> c(HCO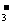 )>c(H+)
)>c(H+)
15. 答案:AC
答案:AC
 详解:NH4HSO4溶液中滴加NaOH溶液有两个主要反应:2NH4HSO4+2NaOH=Na2SO4+(NH4)2SO4+2H2O(I)和NH4HSO4+2NaOH=Na2SO4+NH3
·H2O+H2O(II),在II式中溶液呈碱性,不符合题意;在I式中由于NH
详解:NH4HSO4溶液中滴加NaOH溶液有两个主要反应:2NH4HSO4+2NaOH=Na2SO4+(NH4)2SO4+2H2O(I)和NH4HSO4+2NaOH=Na2SO4+NH3
·H2O+H2O(II),在II式中溶液呈碱性,不符合题意;在I式中由于NH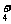 水解呈酸性,有离子浓度关系式:c(Na+)=c(SO
水解呈酸性,有离子浓度关系式:c(Na+)=c(SO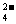 )>c(NH
)>c(NH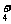 ),题给信息溶液呈中性,必须向溶液中继续滴入NaOH溶液才能使溶液呈中性,继续滴入NaOH导致n(Na+)增大的同时n(NH
),题给信息溶液呈中性,必须向溶液中继续滴入NaOH溶液才能使溶液呈中性,继续滴入NaOH导致n(Na+)增大的同时n(NH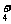 )减小,n(SO
)减小,n(SO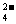 )不变,溶液中的溶质离子浓度关系:c(Na+)>c(SO
)不变,溶液中的溶质离子浓度关系:c(Na+)>c(SO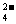 )>c(NH
)>c(NH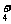 ),A正确。NaHCO3溶液中因为HCO
),A正确。NaHCO3溶液中因为HCO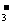 结合水电离出来的H+破坏水的电离平衡使得溶液呈碱性[c(OH-)>c(H+)]的同时c(Na+)>
c(HCO
结合水电离出来的H+破坏水的电离平衡使得溶液呈碱性[c(OH-)>c(H+)]的同时c(Na+)>
c(HCO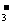 ),由于单一水解是微弱的,溶质离子的浓度大于溶剂离子的浓度,得出c(Na+)> c(HCO
),由于单一水解是微弱的,溶质离子的浓度大于溶剂离子的浓度,得出c(Na+)> c(HCO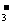 )>c(OH-)>c(H+),B错误;Na2CO3溶液不水解时有溶剂守恒:c(H+) =c(OH-),由于CO
)>c(OH-)>c(H+),B错误;Na2CO3溶液不水解时有溶剂守恒:c(H+) =c(OH-),由于CO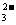 水解生成HCO
水解生成HCO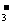 、H2CO3的时候分别消耗了1份、2份H+,考虑CO
、H2CO3的时候分别消耗了1份、2份H+,考虑CO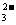 水解的溶剂守恒式为:c(OH-)=c(H+)+c(HCO
水解的溶剂守恒式为:c(OH-)=c(H+)+c(HCO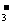 )+2 c(H2CO3)
)+2 c(H2CO3) ,C正确。25℃时,浓度均为0.1mol/L 的CH3COOH 、CH3COONa混合溶液,CH3COOH溶液电离呈酸性,CH3COONa溶液水解呈碱性,而溶液混合pH=4.75[c(OH-)<c(H+)],说明溶液混合后CH3COOH电离起决定作用CH3COONa水解可以忽略,c(CH3COOH)减小,c(CH3COO-)增大,得出离子浓度关系:c(CH3COO-)> c(CH3COOH),可以得出关系:c(CH3COO-)- c(CH3COOH)> c(H+)-
c(OH-)>0,即:c(CH3COO-)+ c(OH-)> c(H+)+ c(CH3COOH),D错误。
,C正确。25℃时,浓度均为0.1mol/L 的CH3COOH 、CH3COONa混合溶液,CH3COOH溶液电离呈酸性,CH3COONa溶液水解呈碱性,而溶液混合pH=4.75[c(OH-)<c(H+)],说明溶液混合后CH3COOH电离起决定作用CH3COONa水解可以忽略,c(CH3COOH)减小,c(CH3COO-)增大,得出离子浓度关系:c(CH3COO-)> c(CH3COOH),可以得出关系:c(CH3COO-)- c(CH3COOH)> c(H+)-
c(OH-)>0,即:c(CH3COO-)+ c(OH-)> c(H+)+ c(CH3COOH),D错误。
 要点1:两种溶液反应至中性的混合液中离子浓度分析一定要借助反应的化学方程式进行分析。
要点1:两种溶液反应至中性的混合液中离子浓度分析一定要借助反应的化学方程式进行分析。
要点2:缓冲溶液中的离子浓度分析一定要借助缓冲溶液的酸碱性帮助分析确定电离和水解哪种因素起决定作用。
要点3:单一溶液中的离子浓度分析要考虑三个守恒式(溶质、溶剂、电荷)和一个大小关系式。
15.(江苏化学卷第13题,3分) 下列溶液中微粒的物质的量浓度关系正确的是
下列溶液中微粒的物质的量浓度关系正确的是
 A.室温下,向0.01mol/LNH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO
A.室温下,向0.01mol/LNH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO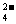 )>c(NH
)>c(NH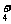 )>c(OH-)=c(H+)
)>c(OH-)=c(H+)
 B.0.1mol/LNaHCO3溶液:c(Na+)>c(OH-)> c(HCO
B.0.1mol/LNaHCO3溶液:c(Na+)>c(OH-)> c(HCO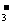 )>c(H+)
)>c(H+)
 C.Na2CO3溶液:c(OH-)-c(H+)=c(HCO
C.Na2CO3溶液:c(OH-)-c(H+)=c(HCO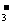 )+2 c(H2CO3)
)+2 c(H2CO3)
 D.25℃时,pH=4.75、浓度均为0.1mol/L
的CH3COOH 、CH3COONa混合溶液:
D.25℃时,pH=4.75、浓度均为0.1mol/L
的CH3COOH 、CH3COONa混合溶液:
c(CH3COO-)+c(OH-)<c(H+)+ c(CH3COOH)
14.答案:C
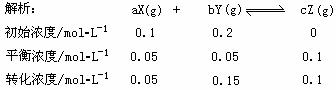
转化浓度之比等于剂量数之比,得出化学方程式为:X(g)+3Y(g)  2Z(g),平衡常数K=
2Z(g),平衡常数K=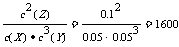 ,B正确;X的转化率:
,B正确;X的转化率: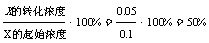 ,A正确。
,A正确。
平衡常数只是温度的函数,改变温度平衡常数发生改变,D正确,增大压强使平衡向生成Z的方向移动,但是并不影响平衡常数。
要点1:化学反应的各物质的计量数之比等于对应物质的转化浓度之比,对反应物而言,转化浓度等于起始浓度减去平衡浓度,对生成物而言,转化浓度等于平衡浓度减去起始浓度。
要点2:某种反应物的转化率等于该物质的转化浓度和该物质的起始浓度之比再乘以百分之百。
要点3:平衡常数只是温度的函数,浓度、压强、催化剂等外界条件的改变不会影响平衡常数,可逆反应的正反应和逆反应得平衡常数互为倒数关系,纯固态和纯液态的物质的浓度不会体现在平衡常数关系式中。
14.(海南化学卷第4题,3分)在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
|
物质 |
X |
Y |
Z |
|
初始浓度/mol·L-1 |
0.1 |
0.2 |
0 |
|
平衡浓度/mol·L-1 |
0.05 |
0.05 |
0.1 |
下列说法错误的是
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大 D.改变温度可以改变此反应的平衡常数
13. 答案:C
答案:C
 解析:若Va>Vb,醋酸过量,根据物料守恒可知,n(CH3COOH)+ n(CH3COO-)=0.05Va,n(K+)= 0.05Vb,则A选项正确;若Va=Vb,反应后为CH3COOK溶液,由于的CH3COO-水解而显碱性,根据质子守恒可知,B选项正确;Va=Vb,反应后为CH3COOK溶液,由于的CH3COO-水解而显碱性c(K+)>c(CH3COO-),
解析:若Va>Vb,醋酸过量,根据物料守恒可知,n(CH3COOH)+ n(CH3COO-)=0.05Va,n(K+)= 0.05Vb,则A选项正确;若Va=Vb,反应后为CH3COOK溶液,由于的CH3COO-水解而显碱性,根据质子守恒可知,B选项正确;Va=Vb,反应后为CH3COOK溶液,由于的CH3COO-水解而显碱性c(K+)>c(CH3COO-),
Va<Vb时,碱过量,仍然存在c(K+)>c(CH3COO-),C选项错误;D选项符合电荷守恒正确。
要点:向体积为Va的0.05mol·L-1CH3COOH溶液中加入体积为Vb 的0.05mol·L-1KOH溶液,混合溶液的酸碱性关系及其对应的离子浓度关系有如下五种情况:
(1)Va>Vb溶液呈酸性的情况:c(CH3COO-)-c(K+)=c(H+)-c(OH-)>0;c(CH3COO-)>c(K+)> c(H+)>c(OH-)
(2)Va>Vb溶液呈中性的情况:c(CH3COO-)-c(K+)=c(H+)-c(OH-)=0;c(CH3COO-)=c(K+)> c(H+)=c(OH-)
(3)Va=Vb溶液呈碱性的情况:c(CH3COO-)-c(K+)=c(H+)-c(OH-)<0;c(H+)<c(OH-)<c(CH3COO-)< c(K+)
(4)Va<Vb溶液呈碱性的情况:c(CH3COO-)-c(K+)=c(H+)-c(OH-)<0;c(H+)<c(OH-)<c(CH3COO-)< c(K+)
或c(H+)<c(CH3COO-) <c(OH-)< c(K+)
(5)Va与Vb任意比的酸碱性不确定的情况:c(CH3COO-)-c(K+)=c(H+)-c(OH-)
13.(安徽理综第13题,6分) 向体积为Va的0.05mol·L-1CH3COOH溶液中加入体积为Vb 的0.05mol·L-1KOH溶液,下列关系错误的是
向体积为Va的0.05mol·L-1CH3COOH溶液中加入体积为Vb 的0.05mol·L-1KOH溶液,下列关系错误的是
 A. Va>Vb时:c (CH3COOH)
+c (CH3COO-)>c (K+)
A. Va>Vb时:c (CH3COOH)
+c (CH3COO-)>c (K+)
 B. Va=Vb时:c (CH3COOH)
+c (H+)=c (OH-)
B. Va=Vb时:c (CH3COOH)
+c (H+)=c (OH-)
 C. Va<Vb时:c (CH3COO-)>c
(K+)> c (OH-)>
c (H)
C. Va<Vb时:c (CH3COO-)>c
(K+)> c (OH-)>
c (H)
 D. Va与Vb任意比时:c (K+)+ c
(H+) =c (OH-)+ c
(CH3COO-)
D. Va与Vb任意比时:c (K+)+ c
(H+) =c (OH-)+ c
(CH3COO-)
12. 答案:C
解析:溶液由溶质和溶剂组成,NaHCO3溶液中存在溶剂水的电离平衡(H2O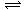 H+
+OH-)和溶质阴离子HCO
H+
+OH-)和溶质阴离子HCO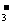 的电离平衡(HCO
的电离平衡(HCO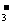
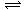 H+
+CO
H+
+CO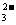 ),Na2CO3溶液中只存在溶剂水的电离平衡,NaHCO3和Na2CO3溶液都是强碱弱酸盐,都可以发生水解,存在水解平衡(HCO
),Na2CO3溶液中只存在溶剂水的电离平衡,NaHCO3和Na2CO3溶液都是强碱弱酸盐,都可以发生水解,存在水解平衡(HCO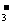 +H2O
+H2O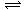 H2CO3+OH-
,CO
H2CO3+OH-
,CO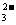 +H2O
+H2O HCO
HCO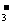 +OH-),其中Na2CO3包括两个水解平衡,A正确不符合题意;根据前面分析的电离平衡和水解平衡,得知NaHCO3和Na2CO3溶液中存在共同的微粒成分:2种分子:H2O
、H2CO3 ,5种离子:Na+
、HCO
+OH-),其中Na2CO3包括两个水解平衡,A正确不符合题意;根据前面分析的电离平衡和水解平衡,得知NaHCO3和Na2CO3溶液中存在共同的微粒成分:2种分子:H2O
、H2CO3 ,5种离子:Na+
、HCO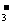 、CO
、CO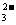 、OH-、H+
B正确不符合题意;同浓度时CO
、OH-、H+
B正确不符合题意;同浓度时CO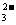 水解程度比HCO
水解程度比HCO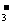 强,Na2CO3溶液的碱性比同浓度的NaHCO3溶液的碱性强,即NaHCO3和Na2CO3溶液中c(OH-)前者小于后者,C错误符合题意;分别加入NaOH固体,NaHCO3和NaOH发生中和反应,c(CO
强,Na2CO3溶液的碱性比同浓度的NaHCO3溶液的碱性强,即NaHCO3和Na2CO3溶液中c(OH-)前者小于后者,C错误符合题意;分别加入NaOH固体,NaHCO3和NaOH发生中和反应,c(CO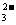 )增大,Na2CO3溶液中加入NaOH固体抑制碳酸钠水解,c(CO
)增大,Na2CO3溶液中加入NaOH固体抑制碳酸钠水解,c(CO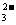 )增大 ,当然分别加入NaOH固体,NaOH固体溶于水放热,能促进水解,使c(CO
)增大 ,当然分别加入NaOH固体,NaOH固体溶于水放热,能促进水解,使c(CO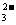 )都减小,但是恢复到原温度,这种温度因素消失,溶液中的氢氧根离子的作用不会因温度的降低而消失,最终c(CO
)都减小,但是恢复到原温度,这种温度因素消失,溶液中的氢氧根离子的作用不会因温度的降低而消失,最终c(CO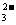 )都增大 ,D正确不符合题意。
)都增大 ,D正确不符合题意。
要点:①溶液中的电离平衡和水解平衡的分析;②根据溶液中的电离平衡和水解平衡分析溶液中存在哪些分子和哪些离子(溶液中的粒子种类分析);③比较同浓度溶液水解或电离以后溶液的酸碱性强弱 ;④外界条件(温度、浓度、压强等)对水解平衡和电离平衡的影响。
12.(天津理综第2题,6分)25 ℃时,浓度均为0.2 mol/L的NaHCO3和Na2CO3溶液中,下列判断不正确的是
A.均存在电离平衡和水解平衡 B.存在的粒子种类相同
C.c(OH-)前者大于后者 D.分别加入NaOH固体,恢复到原温度,c(CO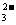 )均增大
)均增大
11.答案:AB
详解:硝酸为强电解质,完全电离,硝酸溶液的浓度等于硝酸溶液的c(H+),pH为1的硝酸溶液c(H+)=c(HNO3)=0.1mol·L-1,根据稀释定律,C1V1=C2V2
,0.1×1=C2×100,C2=0.001,pH=3,A项正确。pH为13的氢氧化钡溶液中c(H+)=1×10-13mol·L-1,c(OH-)=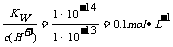 ,B选项正确。硝酸电离出的c(H+)为0.1 mol/l,硝酸溶液中的c(OH-)=
,B选项正确。硝酸电离出的c(H+)为0.1 mol/l,硝酸溶液中的c(OH-)=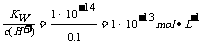 ,硝酸溶液中水电离出来的c(OH-)与水电离出的c(H+)相等为10-13 mol/L,该溶液中硝酸电离出的
,硝酸溶液中水电离出来的c(OH-)与水电离出的c(H+)相等为10-13 mol/L,该溶液中硝酸电离出的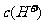 与水电离出的
与水电离出的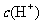 之比值为1012,C项错。pH为3的硝酸中水电离出的c(H+)为10-11mol/l,故D项的比值应为1:100,D选项错误。
之比值为1012,C项错。pH为3的硝酸中水电离出的c(H+)为10-11mol/l,故D项的比值应为1:100,D选项错误。
要点1:pH=a的强酸溶液稀释10n倍,稀释后溶液的pH=a+n≤7, pH=a的弱酸溶液稀释10n倍,稀释后溶液的pH<a+n≤7;pH=b的强碱溶液稀释10n倍,稀释后溶液的pH=b-n≥7, pH=b的弱碱溶液稀释10n倍,稀释后溶液的pH>b-n≥7。
要点2:强酸溶液中c(H+)远大于水电离出来的c(H+)水 ,强酸溶液中OH-是溶剂水电离出来的,溶剂水电离出来的c(H+)水=c(OH-), c(H+)水=c(OH-)=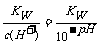 ;强碱溶液中c(OH-)远大于水电离出来的
;强碱溶液中c(OH-)远大于水电离出来的
c(OH-)水 ,强碱溶液中H+是溶剂水电离出来的,溶剂水电离出来的c(OH-)水=c(H+), c(OH-)水=c(H+)=10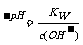 ;
;
-----------------------------------------------------------------------------------------------------------------------------------------
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com