

解读山水田园诗必须要掌握的一个方法是什么?--借助诗人所描绘的景物体会诗人情感。
山水田园诗,它们是自然的画卷,更是诗人情感的载体。田园一角,“鸡鸣桑树颠,狗吠深巷中”,“牧童驱犊返,猎马带禽归”(王绩〈野望〉),湖光山色,“明月松间照,清泉石上流”,“白水明田外,碧峰出山後。”(王维〈新晴野望〉)这些景物,一旦进入诗篇,总是会打上诗人情感的烙印,或愉悦,或宁静,或闲散,或孤清……真是山山水水总关情,一切景语皆情语。
鉴赏山水田园诗,要注意从以下几个角度去掌握:
(四)感情复杂,不一而足。
作者在诗歌中表现的情感不止一种,往往是闲适、寂寞、岁月流逝、报国无门、远离他乡等二种或多种的并存。还有一部分诗作反映农村生活与人民生活的贫困,或揭露封建剥削(主要是范成大)
野望(唐)王 绩
东皋①薄暮望,徙倚②欲何依。
树树皆秋色,山山唯落晖。
牧人驱犊返,猎马带禽归。
相顾无相识,长歌怀采薇。③
[注]①东皋(gāo):诗人隐居的地方。 ②徙倚:徘徊义。 ③采薇:此处用古代隐士伯夷、叔齐的典故。武王平定了商纣,伯夷、叔齐耻食周粟,隐于首阳山,采薇而食。
(1)简析这首诗是怎样扣住“望”字有层次地展开景物描写的。(4分)
(2)结合全诗说说作者在对山野秋色的描写中表露了怎样一种心情。(4)
(二)厌恶官场,向往隐逸
诗人们通过对山水风光、田园生活的描写,来表达尘世官场的污浊、对现实的不满,怀才不遇的苦闷,以及对自由的追求和对宁静、平和、隐逸生活的渴望,抒发一种宁静闲适的生活情趣。
夜归鹿门歌 孟浩然
山寺钟鸣昼已昏,渔梁渡头争渡喧。人随沙岸向江村,余亦乘舟归鹿门。
鹿门月照开烟树,忽到庞公栖隐处。岩扉松径长寂寥,惟有幽人独来去。
辋川闲居赠裴秀才迪 王维
寒山转苍翠,秋水日潺湲。倚杖柴门外,临风听暮蝉。
渡头馀落日,墟里上孤烟。复值接舆醉,狂歌五柳前。
终南别业 王维
中岁颇好道,晚家南山陲。兴来每独往,胜事空自知。
行到水穷处,坐看云起时。偶然值林叟,谈笑无还期。
问题:这类诗歌中,诗人常会选取哪些富有特点的景物(意象)?你认为这些景物与诗人的隐逸之情能做到和谐统一、情景交融吗?请结合诗歌举例予以分析。(学生讨论解决)
1.常出现的景物有:
2.常出现的人物有:
3.这些景物和人物的共性特点:
表达对仕途官场的厌倦,对归隐山林的向往和对闲适恬淡的田园生活的热爱,是山水田园诗中最常见的情感。为了表现这些情感,诗人总会选择一些富有代表性的、融入了自己爱憎情感的景物,借景抒情,情景交融。
⒈概念
诗人把细腻的笔触投向静谧的山水,悠闲的田野,创造一种田园牧歌式的生活,借以表达对现实的不满,对宁静平和生活的向往和自己遗世独立的高尚情怀。
2.山水田园诗特点
以描绘自然山水和田园风光为主要内容,表现返朴归真、怡情养性的情趣,抒写隐逸生活的闲情逸志。他们的诗歌风格清新自然,意境淡远闲适,写景状物工致传神,语言质朴淡雅,提高了诗歌表现自然景物的艺术技巧。这类诗歌的主要特点就是“一切景语皆情语”,亦即作者笔下的山水自然景物都融入了作者的主观情愫,或者借景抒情,或者情景交融地表达作者的思想感情。
17.答案:BC
详解:Ksp只与温度有关,与浓度大小无关,A错误;根据图中显示:三个不同温度中,313K时沉淀溶解平衡曲线中的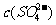 、c(Sr2+)最大,Ksp(SrSO4)最大,B正确;图中a点在283K沉淀溶解平衡曲线的下方,Qc<Ksp,对应的溶液是不饱和溶液,C正确; 283K下的SrSO4饱和溶液升温到363K后,Qc>Ksp,饱和溶液变为过饱和溶液,D错误。
、c(Sr2+)最大,Ksp(SrSO4)最大,B正确;图中a点在283K沉淀溶解平衡曲线的下方,Qc<Ksp,对应的溶液是不饱和溶液,C正确; 283K下的SrSO4饱和溶液升温到363K后,Qc>Ksp,饱和溶液变为过饱和溶液,D错误。
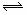 要点1:对于沉淀溶解平衡:MmAn(s)
mMn+ (aq)+nAm-(aq),平衡常数为:Ksp=[c(Mn+)]m
·[c(Am-)]n
要点1:对于沉淀溶解平衡:MmAn(s)
mMn+ (aq)+nAm-(aq),平衡常数为:Ksp=[c(Mn+)]m
·[c(Am-)]n
说明:固体纯物质不列入平衡常数。
要点2:在一定温度下,Ksp(溶度积)是一个常数,是一个只与温度有关的常数,只有温度的改变Ksp才会发生变化,与浓度的变化与否无关。
要点3:比较溶度积与离子积的相对大小,判断难溶电解质在给定条件下沉淀能否生成或溶解:
(1)Qc>Ksp ,溶液过饱和,有沉淀析出,直至溶液饱和,达到新的平衡。
(2)Qc=Ksp ,沉淀于溶解处于平衡状态。
(3)Qc<Ksp,溶液未饱和,无沉淀析出,若加入过量难溶电解质,难溶电解质溶解直至溶液饱和。
17.(广东化学卷第18题,4分)硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下,下列说法正确的是
A.温度一定时,Ksp(SrSO4)随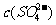 的增大而减小
的增大而减小
B.三个不同温度中,313K时Ksp(SrSO4)最大
C.283K时,图中a点对应的溶液是不饱和溶液
D.283K下的SrSO4饱和溶液升温到363K后变为不饱和溶液

16.答案:D
详解:1体积水溶解2体积氯气,溶于水的部分氯气和水反应生成盐酸和次氯酸,即氯气和水的反应是可逆反应,与水反应的氯气不一定是溶于水的氯气的一半,A错误;氯水中:Cl2+H2O HCl+HClO;HCl=H+
+Cl- ;HClO
HCl+HClO;HCl=H+
+Cl- ;HClO H+
+ClO- ;氯气和水反应生成的等量的盐酸和次氯酸,盐酸全部电离,次氯酸部分电离,酸性溶液中c(OH-)最小,c(H+)>c(Cl-)>c(ClO-)>c(OH-)
H+
+ClO- ;氯气和水反应生成的等量的盐酸和次氯酸,盐酸全部电离,次氯酸部分电离,酸性溶液中c(OH-)最小,c(H+)>c(Cl-)>c(ClO-)>c(OH-) ,B错误;等体积等浓度的氢氧化钠与醋酸混合恰好生成醋酸钠和水,分析溶液中的离子浓度关系实质上是分析产物醋酸钠溶液中的离子浓度关系,根据电荷守恒式c(Na+)+ c(H+)= c(CH3COO-)+
,B错误;等体积等浓度的氢氧化钠与醋酸混合恰好生成醋酸钠和水,分析溶液中的离子浓度关系实质上是分析产物醋酸钠溶液中的离子浓度关系,根据电荷守恒式c(Na+)+ c(H+)= c(CH3COO-)+ c(OH-)得出变换的电荷守恒式为:c(Na+)- c(CH3COO-) =
c(OH-)得出变换的电荷守恒式为:c(Na+)- c(CH3COO-) = c(OH-)
-c(H+),因为醋酸钠水解呈碱性,c(OH-)>c(H+),所以c(Na+)>c(CH3COO-),C错误;
c(OH-)
-c(H+),因为醋酸钠水解呈碱性,c(OH-)>c(H+),所以c(Na+)>c(CH3COO-),C错误; Na2CO3溶液中有两个电离方程式和两个水解的离子方程式(Na2CO3=2Na+ + CO
Na2CO3溶液中有两个电离方程式和两个水解的离子方程式(Na2CO3=2Na+ + CO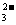 ;H2O
;H2O H+
+OH- ;CO
H+
+OH- ;CO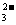 +H2O
+H2O HCO
HCO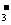 +OH- , HCO
+OH- , HCO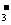 +H2O
+H2O  H2CO3+OH-
);①不考虑水解:溶液中只有四种离子(Na+ 、CO
H2CO3+OH-
);①不考虑水解:溶液中只有四种离子(Na+ 、CO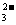 、H+ 、OH-)溶液呈中性;离子浓度关系有:c(Na+)=2c(CO
、H+ 、OH-)溶液呈中性;离子浓度关系有:c(Na+)=2c(CO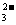 );c(H+)=c(OH-),②考虑水解:由于CO
);c(H+)=c(OH-),②考虑水解:由于CO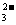 水解,溶液中的微粒成分增加了两种成份(HCO
水解,溶液中的微粒成分增加了两种成份(HCO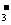 、H2CO3),并破坏了原先的离子浓度的等式关系,CO
、H2CO3),并破坏了原先的离子浓度的等式关系,CO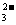 在破坏水的电离平衡的同时,自身浓度也发生了变化,导致c(Na+)> 2c(CO
在破坏水的电离平衡的同时,自身浓度也发生了变化,导致c(Na+)> 2c(CO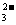 )和c(H+)<c(OH-);在CO
)和c(H+)<c(OH-);在CO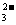 的第一步水解的离子方程式(CO
的第一步水解的离子方程式(CO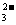 +H2O
+H2O HCO
HCO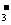 +OH-)中可以看出产物c(OH-)= c(HCO
+OH-)中可以看出产物c(OH-)= c(HCO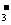 ),由于CO
),由于CO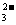 第二步水解(HCO
第二步水解(HCO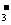 +H2O
+H2O  H2CO3+OH-
)的发生,导致c(HCO
H2CO3+OH-
)的发生,导致c(HCO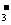 )减少的同时又增加了c(OH-),使得c(OH-)>c(HCO
)减少的同时又增加了c(OH-),使得c(OH-)>c(HCO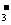 ),在盐溶液中,单一的水解是微弱的,溶质电离出来的离子的浓度一定大于水解反应新增的离子浓度,水解呈碱性的溶液中氢离子浓度最小,得出离子浓度关系式D正确。
),在盐溶液中,单一的水解是微弱的,溶质电离出来的离子的浓度一定大于水解反应新增的离子浓度,水解呈碱性的溶液中氢离子浓度最小,得出离子浓度关系式D正确。
要点1:溶液混合后离子浓度的分析试题解题方法:首先要写出产物的电离方程式、水解方程式,其次分析出溶液中的微粒(离子、分子)成分,并写出电荷守恒式、溶质守恒式、溶剂守恒式,最后根据题给信息(溶液的酸碱性信息)和以上三式(电荷守恒式、溶质守恒式、溶剂守恒式)导出离子浓度的大小关系。
要点2:等体积等浓度的氢氧化钠与醋酸混合后溶液中的离子浓度关系有:
(1)溶质守恒: c(Na+)=c(CH3COO-)+c(CH3COOH)
 ;c(Na+)>c(CH3COO-)
;c(Na+)>c(CH3COO-)
(2)溶剂守恒:c(H+)+
c(CH3COOH) =c(OH-);c(H+)>c(OH-)
=c(OH-);c(H+)>c(OH-)
(3)电荷守恒:c(Na+)+
c(H+)= c(CH3COO-)+ c(OH-)
c(OH-)
(4)大小关系:溶质离子的浓度大于溶剂离子的浓度(单一水解是微弱的)
c(Na+)>c(CH3COO-)> c(H+)>c(OH-)。
要点3:Na2CO3溶液中的离子浓度关系有:
(1)溶质守恒: c(Na+)=2[c(CO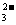 )+c(HCO
)+c(HCO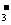 ) + c(H2CO3)]
) + c(H2CO3)] ;c(Na+)>
2c(CO
;c(Na+)>
2c(CO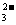 )
)
(2)溶剂守恒:c(H+)+
c(HCO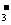 )+2 c(H2CO3)
)+2 c(H2CO3) =c(OH-);c(H+)<c(OH-)
=c(OH-);c(H+)<c(OH-)
(3)电荷守恒:c(Na+)+
c(H+)= 2c(CO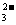 )+c(HCO
)+c(HCO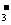 ) +
) + c(OH-)
c(OH-)
(4)大小关系:溶质离子的浓度大于溶剂离子的浓度(单一水解是微弱的)
c(Na+)>c(CO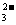 )
) >c(OH-)> c(HCO
>c(OH-)> c(HCO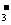 )>c(H+)
)>c(H+)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com