
1、大气的热力作用
(1)大气对太阳辐射的削弱作用:反射作用最强,吸收作用最弱
吸收:有选择性。臭氧吸收紫外线,水汽、二氧化碳吸收波长较长的红外线,大气直接吸收太阳辐射很少
反射:无选择性,云的反射作用最为显著。卫星云图上白色越浓,云层越厚,反射太阳光最多。地面性质与反射:新雪最强。
散射:有选择性。蓝、紫色光最容易被散射,所以晴朗天空呈现蔚蓝色。天空呈灰白色是因为太阳光被较多尘埃和雾粒散射的缘故。
削弱作用与太阳高度:太阳高度大的地区太阳辐射经过大气路程短,削弱得少。
(2)大气的保温效应
温度高低与波长长短关系:温度高,辐射最强部分波长短。太阳辐射波长小于地面辐射和大气辐射。地面吸收太阳辐射而增温。
大气把地面辐射的绝大部分吸收(长波辐射,水汽和二氧化碳吸收)。
大气以逆辐射的形式把能量返还地面,补偿地面损失的热量。
实例:1、多云的夜晚,气温变化小。(大气逆辐射强)
3、垂直分层
①依据:温度、密度和大气运动状况在垂直方向上的差异。
②各层的特点及原因:
|
层次 |
特 点 |
原 因 |
|
对流层 |
①气温随高度增加而递减,每上升100米降低0.6℃。 ②对流动动显著(低纬17~18、中纬10~12、高纬8~9千米)。 ③天气现象复杂多变。 |
热量绝大部分来自地面,上冷下热,差异大,对流强, 水汽杂质多、对流运动显著。 |
|
平流层 |
起初气温变化小,30千米以上气温迅速上升。 大气以水平运动为主。 大气平稳天气晴朗有利高空飞行。 |
臭氧吸收紫外线。 上热下冷。 水汽杂质少、水平运动。 |
|
高层 大气 |
存在若干电离层,能反射无线电波,对无线电通信有重要作用。[自下而上分三层:中间层、暖层(电离层)、逃逸层] |
太阳紫外线和宇宙射线作用 |
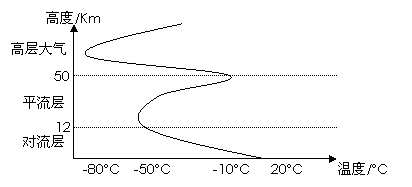 大气温度随高度变化曲线:
大气温度随高度变化曲线:
逆温现象:对流层由于热量主要直接来自地面辐射,所以海拔越高,气温越低。一般情况下,海拔每上升1000米,气温下降6°C。有时候出现下列情况:①海拔上升,气温升高;②海拔上升1000米,气温下降幅度小于6°C。这就是逆温现象。逆温现象往往出现在近地面气温较低的时候,如冬季的早晨。逆温现象使空气对流运动减弱,大气中的污染物不易扩散,大气环境较差。
例1、比较同纬度青藏高原与长江中下游平原上空海拔均为5000米的A、B两点气温TA、TB的大小。(TA>TB)(地面是大气的直接热源。)
2、大气的组成:
 氮:含量最多(78%)是生物体的基本成分。
氮:含量最多(78%)是生物体的基本成分。
干洁 氧:含量第二(21%)是人类和一切生物维持生命活动必需的物质。
空气 二氧化碳:光合作用的重要原料,对地面有保温作用。
组成 臭氧:大量吸收紫外线,使生物免遭伤害,少量紫外线有杀菌作用。
 水汽
水汽
成云致雨的必要条件——雨后的空气是清新的。
固体杂质
地球变暖的原因:①人类活动燃烧煤、石油等矿物燃料,排放大量的CO2,使大气中的CO2增加;②植被的破坏,光合作用吸收的CO2减少。
1、地球外部的四大圈层:大气圈、水圈、岩石圈、生物圈。
大气圈的作用:保护作用;使水循环;雕塑地表形态;对生物界和人类影响更为深刻。
29.(13分)烧碱(NaOH)是一种重要的化工原料,广泛应用于肥皂、造纸等工业。下面有一些关于烧碱的问题,请按要求解答:
(1)烧碱在工业上通常用电解饱和NaCl水溶液的方法制取,产物除烧碱外,还有H2和Cl2,请写出电解饱和NaCl水溶液的化学方程式 。(2)烧碱放在空气中会变质生成碳酸钠。现有14.6 g暴露在空气中的烧碱样品,全部溶于水,然后滴加足量Ca(OH)2溶液,充分反应后,过滤,烘干得10 g沉淀,则样品的组成为
A.全部为Na2CO3
B.4 g NaCO3和10.6 g NaOH
C.全部为NaOH
D.4 g NaOH和10.6 g Na2CO3
(3)酸碱中和反应在工农业生产和科研上具有很大用途,但氢氧化钠溶液和盐酸反应时看不到明显现象,请你设计一个实验,通过观察到的明显现象,说明氢氧化钠溶液与盐酸发生了反应。
(4)若中和反应需要60 g 10%的NaOH溶液,现提供50g 20%的NaOH溶液、40 g 5%的NaOH溶液以及足够的NaOH固体和水,请选用以上提供的药品设计两种配制方案(只要说明配制所需的各种药品用量)填入下表中。
|
序号 |
配制方案 |
|
举例 |
6 g NaOH固体和54 g水 |
|
方案1 |
|
|
方案2 |
|
(5)下图是某学生用氢氧化钠固体和水配制60 g10%NaOH溶液的部分操作过程,该同学在称量氢氧化钠时,先在两个托盘上各放一张质量相同的纸,然后把药品直接放在纸上称量。
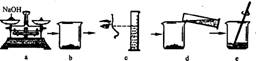
①a操作中的错误是 。
②下列操作中导致溶质质量分数偏低的是 (填字母)。
A.a操作中砝码和氢氧化钠放错盘
B.b中烧杯用水洗涤后未干燥就使用
C.c操作中平视量筒凹液面最低处读数为50 mL
28.(8分)我国目前使用的燃料主要是煤和石油,含有硫的煤燃烧时生成的SO2会污染空气。
(1)某火力发电厂每天燃烧含硫1.6%的煤100 t,若煤中的硫全部转化为SO2,则该厂每天产生SO2 t。为防止SO3污染,可将SO2通入石灰乳中生成Ca(HSO3)2,则该反应的化学方程式为 。
(2)国家标准规定工业废气中SO2含量不得超过0.15 mg/m3。工业上测量SO2的含量时,可以根据反应:SO2+2H2O+I2=H2SO4+2HI。现取该厂废气样品1000 L,用0.025 4%的碘(12)溶液2g好完全反应。试计算该厂排放的废气中SO2的含量是否符合国家标准。
27.(3分)2003年10月,我国神舟五号飞船发射成功。在运送飞船的某些火箭推进器中使用的燃料是偏二甲基肼(C2H8N2)。则偏二甲基肼分子中共含有 个原子,偏二甲基肼中碳元素的质量分数为 。
26.(8分)长途运输鱼苗时,人们常在水中加入少量过氧化钙(CaO2)固体。甲、乙两位同学发现往水中投入过氧化钙时产生气泡。提出问题:当把过氧化钙投入足量水中时,最终会生成什么物质呢?
进行猜想:甲同学认为:生成氧化钙和氧气;乙同学认为:生成氢氧化钙和氧气。
(1)你认为 同学的猜想是错误的,其理由是
(2)请设计一个实验方案来验证另一个同学的猜想是正确的,并填入下表空格中。
|
实验步骤及操作方法 |
预期的实验现象 |
结论 |
|
1.取少量过氧化钙放入试管中,加足量水, 。 |
|
有氧气生成 |
|
2. |
|
|
(3)运输鱼苗时,在水中加入少量过氧化钙的主要目的是 。
25. (5分)双氧水(H2O2)不仅可以在美容业除去色斑,也可以在常温下以二氧化锰为催化剂制取MnO2氧气(2H2O2
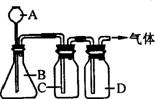
(5分)双氧水(H2O2)不仅可以在美容业除去色斑,也可以在常温下以二氧化锰为催化剂制取MnO2氧气(2H2O2 2H2O+O2↑)。某同学设计了右图装置制取表中的三种干燥、纯净的气体。图中铁架台、铁夹及气体收集装置都已略去,A、B、C、D表示相应仪器中加入的试剂。
2H2O+O2↑)。某同学设计了右图装置制取表中的三种干燥、纯净的气体。图中铁架台、铁夹及气体收集装置都已略去,A、B、C、D表示相应仪器中加入的试剂。
|
气体 |
A |
B |
C |
D |
|
O2 |
双氧水溶液 |
二氧化锰 |
水 |
苛性钠周体 |
|
H2 |
稀硫酸 |
铜 |
氢氧化钠溶液 |
浓硫酸 |
|
CO2 |
稀盐酸 |
大理石 |
氢氧化钠溶液 |
浓硫酸 |
(1)上述方法中可以得到干燥、纯净的气体是 。
(2)指出不能用上述方法得到的气体,并说明理由(可以不填满,也可以补充).
①气体 ,理由是
②气体 ,理由是 。
24.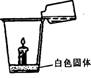 (6分)小明家中有小小实验室,他收集的物质有①溶液:HCl、AgNO3、Ba(OH)2和H2SO4;②固体:NaCl、CaCO3、CuO和Na2CO3。小明按右图所示的方法实验,有气泡产生,一会儿蜡烛熄灭,白色固体消失。看到上述现象后,小明的同学小亮认为试剂瓶中的溶液为盐酸,玻璃杯中的固体为碳酸钙。除此之外,你认为溶液和固体的组合还可能是什么?请填入下表中(任写三种不同组合)。
(6分)小明家中有小小实验室,他收集的物质有①溶液:HCl、AgNO3、Ba(OH)2和H2SO4;②固体:NaCl、CaCO3、CuO和Na2CO3。小明按右图所示的方法实验,有气泡产生,一会儿蜡烛熄灭,白色固体消失。看到上述现象后,小明的同学小亮认为试剂瓶中的溶液为盐酸,玻璃杯中的固体为碳酸钙。除此之外,你认为溶液和固体的组合还可能是什么?请填入下表中(任写三种不同组合)。
|
组合种类 |
1 |
2 |
3 |
|
溶 液 |
|
|
|
|
固 体 |
|
|
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com