
20.(山东胜利一中2008-2009学年度第一学期高三阶段检测化学试题)下列说法正确的是 ( A )
A.燃煤时加入适量石灰石.可减少废气中SO2 的量
B.发酵粉中主要含有氢氧化钠,能使焙制出的糕点疏松多孔
C.pH在 5.6-7.0之间的降水通常称为酸雨
D.含磷合成洗涤剂易于被细菌分解.故不会导致水体污染
19.(山东省潍坊市光华中学2009届高三年级月考化学试题 )下列反应一定不能自发进行
的是 ( B )
A.KClO3 (s)=2KCl(s)+3O2 (s) △H= -78.03 kJ·mol-1 △S=494.4 J·mol-1·K-1
B.CO(g)= C(s,石墨) +1/2O2(g) △H=110.5 kJ·mol-1 △S= -89.36 J·mol-1·K-1
C.4Fe(OH)2(s)+2H2O(l)+O2(g)=4 Fe(OH)3(s) △H=-444.3 kJ·mol-1
△S= -280.1 J·mol-1·K-1
D.NH4HCO3(s)+CH3COOH(aq)= CO2(g)+ CH3COONH4(aq)+H2O(l)
△H=37.301 kJ·mol-1 △S=184.0 J·mol-1·K-1
18.(山东省潍坊市光华中学2009届高三年级月考化学试题 )下列说法正确的是 ( B )
A.放热反应的焓变小于零,熵变大于零
B.放热及熵增加的反应,一定能自发进行
C.放热反应的焓变大于零,熵变小于零
D.放热及熵减小的反应,一定能自发进行
17.( 山东省实验中学2009届高三第一次诊断性测试)化学与生活、社会密切相关。下列说
法不正确的是( B )
A.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境
B.凡含有食品添加剂的食物对人体健康均有害,不可食用
C.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术
D.提倡人们购物时不用塑料袋,是为了防止白色污染
16.(山东省聊城一中08-09学年度上学期高三期末综合测试)己知:①2C(s)+O2(g)=2CO(g);△H1 ② 2CO(g)+O2(g)=2CO2(g);△H2 。下列说法中正确的是( C )
A.碳的燃烧热为0.5△H1kJ/mol B.②为能表示CO燃烧热的热化学方程式
C.碳的燃烧热△H=0.5(△H1+△H2) D.碳的燃烧热小于CO的燃烧热
15、(山东省文登市天福山中学2009届高三第四次月考)合成氨工业对国民经济和社会发展
具有重要的意义。哈伯法合成氨需要在20~50MPa的高压和500℃左右的高温下,并用
铁触媒作为催化剂,氨在平衡混合物中的含量仍较少。
最近英国俄勒冈大学的化学家使用了一种名为 trans一Fe(DMeOPrPE)2 的新催化剂,
在常温下合成氨,反应方程式可表示为N2 +3H2 2NH3 . 有关说法正确的是( BD )
2NH3 . 有关说法正确的是( BD )
A.哈伯法合成氨是吸热反应,新法合成氨是放热反应
B.新法合成氨不需要在高温条件下,可节约大量能源,具有发展前景
C. 新法合成氨能在常温下进行是因为不需要断裂化学键
D. 新催化剂降低了反应所需要的能量,提高了活化分子百分数
14、(山东省文登市天福山中学2009届高三第四次月考)今有如下三个热化学方程式。
H2(g) + 1/2O2(g) == H2O(g) ;△H1 H2(g) + 1/2O2(g) == H2O(l) ;△H2
2H2(g) +O2(g) == 2H2O(g) ;△H3 H2O(l) == H2O(g);△H4
关于它们的下列表述正确的是( AD )
A.△H4 = △H1-△H2 B. △H1 △H2 △H3 △H4均为负值
C.△H1= △H2 D.2△H1 = △H3
13、(山东省文登市天福山中学2009届高三第四次月考)已知2SO2(g)+ O2(g)  2SO3(g);△H=-197kJ/mol,同温下,往相同体积的密闭容器甲、乙中分别充入2molSO2、1molO2 和1molSO3、1molSO2、0.5mol
O2,当它们分别达到平衡时放出的热量为Q1 KJ和Q2KJ,则下列比较正确的是(C )
2SO3(g);△H=-197kJ/mol,同温下,往相同体积的密闭容器甲、乙中分别充入2molSO2、1molO2 和1molSO3、1molSO2、0.5mol
O2,当它们分别达到平衡时放出的热量为Q1 KJ和Q2KJ,则下列比较正确的是(C )
A.Q2= 1/2 Q1=98.5 B.Q2=1/2 Q1<98.5 C.Q2<1/2 Q1<98.5 D.1/2 Q1< Q2 <98.5
12、(山东省文登市天福山中学2009届高三第四次月考)(8分)在火箭推进器中装有还原剂肼(N2H4)和强氧化剂H2O2,当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热。已知0.4mol液态肼和足量H2O2反应生成氮气和水蒸气时放出256.64kJ的热量。
(1)在结构上N2H4和NH3的关系有如H2O2和H2O的关系。N2H4能发生下列反应:
 N2H4+H3O+=N2H5++H2O N2H4+H2O N2H5++OH-
N2H4+H3O+=N2H5++H2O N2H4+H2O N2H5++OH-

 N2H5++H2O N2H62++OH- N2H5++H2O N2H4+H3O+
N2H5++H2O N2H62++OH- N2H5++H2O N2H4+H3O+
据此可得出的结论是 。
A.肼水解显酸性 B.肼在水中可电离出H+离子
C.肼是二元弱碱 D.肼是二元弱酸
(2)写出肼和H2O2反应的热化学方程式 。
(3)已知H2O(1)=H2O(g) △H=+44kJ/mol,则16g液态肼与足量双氧水反应生成氮气和液态水时,放出的热量是 。
(4)上述反应应用于火箭推进器,除释放出大量热量和快速产生大量气体外,还有一个很突出的优点是 。
(5)用氨和次氯酸钠按一定的物质的量之比混合可生成肼,写出反应的化学方程式
,该反应的还原产物
是 。
答案(1)C(1分)
(2)N2H4(1)+2H2O2(1)=N2(g)+4H2O(g);△H= -641.6kJ/mol(2分)
(3)408.8kJ(1分)
(4)产物为氮气和水,无污染(1分)
(5)2NH3+NaClO=N2H4+NaCl+H2O(1分) NaCl(1分)
11.(淄博市2008-2009学年度高三化学第一学期期中考试)在101kPa和25˚C时,有关反应的热化学方程式如下:( D )
C(s)+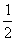 O2(g)=CO(g);△H1= -110 5kJ/mol
O2(g)=CO(g);△H1= -110 5kJ/mol
H2(g)+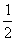 O2(g)=H2O(g);△H2= -241. 7kJ/mol
O2(g)=H2O(g);△H2= -241. 7kJ/mol
H2(g)+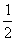 O2(g)=H2O(1);△H3= -285. 8kJ/mol
O2(g)=H2O(1);△H3= -285. 8kJ/mol
下列说法正确的是 ( )
A.C(s)+H2O(g)=CO(g)+H2(g);△H= -131. 2kJ/mol
B.H2燃烧热的热化学方程式为:2H2(g)+O2(g)=2 H2O(1);△H= - 571. 6kJ/mol
C.2H2O(g)= 2H2(g)+O2(g);△H= - 483. 4kJ/mol
D.H2O(g)=H2O(1);△H= - 44. 1kJ/mo1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com