
26. (13分)某兴趣小组为验证日常生活用的火柴头上含有KClO3、MnO2、S,设计了以下实验流程图:
(13分)某兴趣小组为验证日常生活用的火柴头上含有KClO3、MnO2、S,设计了以下实验流程图:
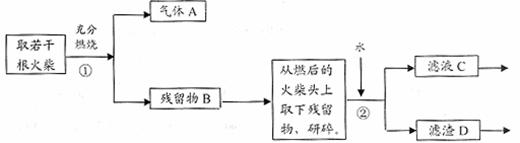







 请回答以下问题:
请回答以下问题:
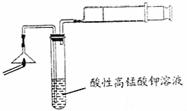
 (1)为验证气体A,按右图所示进行实验:若能
(1)为验证气体A,按右图所示进行实验:若能
 观察到 的现象,即可证明火柴头上含有S元素。
观察到 的现象,即可证明火柴头上含有S元素。
 (2)写出步骤①中发生反应的化学方程式
。
(2)写出步骤①中发生反应的化学方程式
。

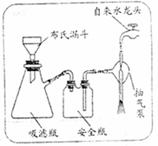 (3)步骤②的实验操作装置如右下图所示,该操
(3)步骤②的实验操作装置如右下图所示,该操
 作的名称是 。
作的名称是 。
 (4)要证明火柴头中含有Cl元素的后续实验步
(4)要证明火柴头中含有Cl元素的后续实验步
 骤是
。
骤是
。
 (5)有学生提出检验火柴头上KClO3另一套实验方案:
(5)有学生提出检验火柴头上KClO3另一套实验方案:
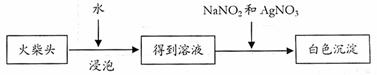




|
 充分说明火柴头上KClO3的存在,其理由是
。
充分说明火柴头上KClO3的存在,其理由是
。
 (6)该小组猜测滤渣D对双氧水分解制氧气的速率会产生一定的影响,设计并进行了以下5次实验。
(6)该小组猜测滤渣D对双氧水分解制氧气的速率会产生一定的影响,设计并进行了以下5次实验。


























|
实验次数 |
H2O2溶液质量分数% |
H2O2溶液用量/毫升 |
物质D用量/克 |
反应温度/℃ |
收集气体体积/毫升 |
所需时间/秒 |
|
① |
30 |
5 |
0 |
85 |
2 |
3.8 |
|
② |
15 |
2 |
0.1 |
20 |
2 |
2.8 |
|
③ |
15 |
2 |
0.2 |
20 |
2 |
2.2 |
|
④ |
5 |
2 |
0.1 |
20 |
2 |
7.4 |
|
⑤ |
30 |
5 |
0 |
55 |
2 |
10.5 |
由上表可知,实验①和⑤能证明温度越高,化学反应速率越快,实验 和
 证明物质D的用量越大,反应速率越快。
证明物质D的用量越大,反应速率越快。

25.
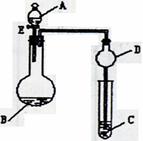 (9分)用如图所示装置(夹持仪器省略)进行实验,将液体A逐滴加入到固体B中,回答下列问题:
(9分)用如图所示装置(夹持仪器省略)进行实验,将液体A逐滴加入到固体B中,回答下列问题:
 (1)图中D装置在实验中的作用是
。
(1)图中D装置在实验中的作用是
。
 (2)若 A为30%H2O2溶液,B为MnO2 ,C盛有氢硫酸(H2S)饱和溶液,旋开E后,C中出现浅黄色浑浊的现象,写出C中发生反应的化学方程式为 。
(2)若 A为30%H2O2溶液,B为MnO2 ,C盛有氢硫酸(H2S)饱和溶液,旋开E后,C中出现浅黄色浑浊的现象,写出C中发生反应的化学方程式为 。
 (3)若A为浓盐酸,B为KMnO4,C中盛有KI淀粉溶液,旋开E后,C中的现象是
;继续通气体于C中,足够长的时间后,发现C中溶液的颜色消失,这是因为在溶液中I2能被Cl2氧化为HIO3(碘酸为强酸),写出该反应的离子反应方程式 。
(3)若A为浓盐酸,B为KMnO4,C中盛有KI淀粉溶液,旋开E后,C中的现象是
;继续通气体于C中,足够长的时间后,发现C中溶液的颜色消失,这是因为在溶液中I2能被Cl2氧化为HIO3(碘酸为强酸),写出该反应的离子反应方程式 。
 (4)若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,旋开E,足够长的时间后,C中的现象是
,C中发生反应的离子方程式为
。
(4)若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,旋开E,足够长的时间后,C中的现象是
,C中发生反应的离子方程式为
。
24. (8分)已知A、B、C、D、E、F、G、H 可以发生如下图所示的转化,反应中部分生成物已略去。其中,A、G为同一主族元素的单质,B、C、H在通常情况下为气体,化合物C是一种形成酸雨的大气污染物。
(8分)已知A、B、C、D、E、F、G、H 可以发生如下图所示的转化,反应中部分生成物已略去。其中,A、G为同一主族元素的单质,B、C、H在通常情况下为气体,化合物C是一种形成酸雨的大气污染物。
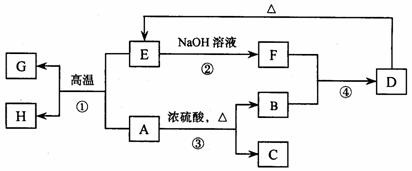






 请填空:
请填空:
 (1)H的名称是
。
(1)H的名称是
。
 (2)E的两种用途是
、
。
(2)E的两种用途是
、
。
 (3)反应③的化学方程式是
。
(3)反应③的化学方程式是
。
 (4)反应④的离子方程式是
。
(4)反应④的离子方程式是
。


























23. (8分)工业制备的高锰酸钾是锰的重要化合物和常用的氧化剂。以下附图是工业上用软锰矿制备高锰酸钾的一种工艺流程。
(8分)工业制备的高锰酸钾是锰的重要化合物和常用的氧化剂。以下附图是工业上用软锰矿制备高锰酸钾的一种工艺流程。
 ⑴KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的是_____(填代号)。
⑴KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的是_____(填代号)。
 a. 84消毒液(NaClO溶液) b. 双氧水 c. 苯酚 d. 75%酒精
a. 84消毒液(NaClO溶液) b. 双氧水 c. 苯酚 d. 75%酒精
 ⑵上述流程中可以循环使用的物质有
、
(写化学式)。
⑵上述流程中可以循环使用的物质有
、
(写化学式)。
 ⑶若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得
mol KMnO4。
⑶若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得
mol KMnO4。

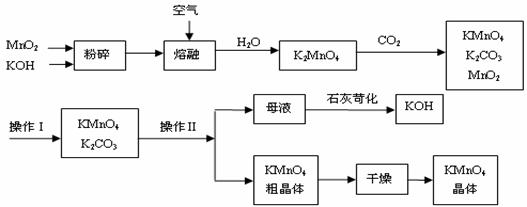 ⑷操作Ⅰ的名称是_____________;操作Ⅱ是根据KMnO4和K2CO3两物质在__________(填性质)上差异,采用____________(填操作步骤)、趁热过滤得到KMnO4粗晶体的。
⑷操作Ⅰ的名称是_____________;操作Ⅱ是根据KMnO4和K2CO3两物质在__________(填性质)上差异,采用____________(填操作步骤)、趁热过滤得到KMnO4粗晶体的。
22. 向m g镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体b L。
向m g镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体b L。
 向反应后的溶液中加入c mol/L氢氧化钾溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。则下列关系不正确的是
向反应后的溶液中加入c mol/L氢氧化钾溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。则下列关系不正确的是
 A.
A.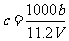 B.
B. C.n=m+17Vc D.
C.n=m+17Vc D.
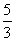 m<
m<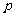 <
<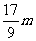

21. 钢铁“发蓝”是将钢铁制品浸到某些氧化性的溶液中,在钢铁的表面形成一层四氧化三铁的技术过程。其中一种办法是将钢铁制品浸到亚硝酸钠和浓氢氧化钠的混合溶液中加热到130℃反应。其过程可以用如下化学方程式表示:
钢铁“发蓝”是将钢铁制品浸到某些氧化性的溶液中,在钢铁的表面形成一层四氧化三铁的技术过程。其中一种办法是将钢铁制品浸到亚硝酸钠和浓氢氧化钠的混合溶液中加热到130℃反应。其过程可以用如下化学方程式表示:
 ① 3Fe+NaNO2+5NaOH =
3Na2FeO2+H2O+NH3↑;
① 3Fe+NaNO2+5NaOH =
3Na2FeO2+H2O+NH3↑;
 ② 6Na2FeO2+NaNO2+5H2O = 3 Na2Fe2O4+
NH3↑+7NaOH;
② 6Na2FeO2+NaNO2+5H2O = 3 Na2Fe2O4+
NH3↑+7NaOH;
 ③ Na2FeO2+ Na2Fe2O4+2H2O =
Fe3O4+4NaOH;
③ Na2FeO2+ Na2Fe2O4+2H2O =
Fe3O4+4NaOH;
 下列说法不正确的是
下列说法不正确的是
 A.该生产过程会产生污染 B.反应②中的氧化剂是NaNO2
A.该生产过程会产生污染 B.反应②中的氧化剂是NaNO2
 C.整个反应过程中每有16.8gFe参加反应转移0.8mol电子
C.整个反应过程中每有16.8gFe参加反应转移0.8mol电子
 D.反应①②③均是氧化还原反应
D.反应①②③均是氧化还原反应
20. 某同学为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使红色石蕊试纸变蓝。由该实验能得到的正确结论是
某同学为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使红色石蕊试纸变蓝。由该实验能得到的正确结论是

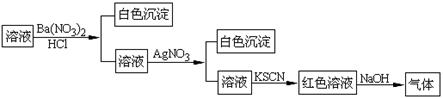



 A.原溶液中一定含有SO42-离子 B.原溶液中一定含有NH4+离子
A.原溶液中一定含有SO42-离子 B.原溶液中一定含有NH4+离子
 C.原溶液中一定含有Cl-离子 D.原溶液中一定含有Fe3+离子
C.原溶液中一定含有Cl-离子 D.原溶液中一定含有Fe3+离子
19.
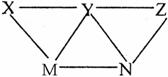 现有H2SO4、BaCl2、K2CO3、FeSO4和氯水五种溶液,有如图所示的相互关系,图中每条连线两端的物质可以发生化学反应。下列推断不合理的是
现有H2SO4、BaCl2、K2CO3、FeSO4和氯水五种溶液,有如图所示的相互关系,图中每条连线两端的物质可以发生化学反应。下列推断不合理的是
 A.X一定为H2SO4
B.Y一定为K2CO3
A.X一定为H2SO4
B.Y一定为K2CO3
 C.Z可能是氯水
D.M可能为FeSO4
C.Z可能是氯水
D.M可能为FeSO4
18. 铜的冶炼大致可分为:
铜的冶炼大致可分为:
 ① 富集,将硫化物矿进行浮选;
① 富集,将硫化物矿进行浮选;
 ② 焙烧,主要反应为:2CuFeS2+4O2=====Cu2S+3SO2+2FeO(炉渣);
② 焙烧,主要反应为:2CuFeS2+4O2=====Cu2S+3SO2+2FeO(炉渣);
 ③ 制粗铜,在1200℃发生的主要反应为:
③ 制粗铜,在1200℃发生的主要反应为:
 2Cu2S+3O2 =====2Cu2O+2SO2
;2Cu2O+ Cu2S
===== 6Cu+SO2↑;
2Cu2S+3O2 =====2Cu2O+2SO2
;2Cu2O+ Cu2S
===== 6Cu+SO2↑;
 ④ 电解精炼铜。
④ 电解精炼铜。
 下列说法正确的是
下列说法正确的是
 A.冶炼过程中的尾气可用来制硫酸
A.冶炼过程中的尾气可用来制硫酸
 B.上述过程中,由1mol CuFeS2制取1molCu时共消耗2 molO2
B.上述过程中,由1mol CuFeS2制取1molCu时共消耗2 molO2
 C.在反应2Cu2O+ Cu2S == 6 Cu+SO2↑中,只有Cu2O作氧化剂
C.在反应2Cu2O+ Cu2S == 6 Cu+SO2↑中,只有Cu2O作氧化剂
 D.电解精炼铜的过程中,每转移1mol电子时,阳极溶解铜的质量为32 g
D.电解精炼铜的过程中,每转移1mol电子时,阳极溶解铜的质量为32 g
17. 在给定条件下,下列加点的物质在化学反应中完全消耗的是
在给定条件下,下列加点的物质在化学反应中完全消耗的是
























 A.用50mL 8mol/L的浓盐酸与10g二氧化锰共热制取氯气
A.用50mL 8mol/L的浓盐酸与10g二氧化锰共热制取氯气
 B.向100mL 3mol/L的硝酸中加入5.6g铁
B.向100mL 3mol/L的硝酸中加入5.6g铁
 C.标准状况下,将1g铝片投入20mL 18.4mol/L的硫酸中
C.标准状况下,将1g铝片投入20mL 18.4mol/L的硫酸中
 D.在5×107Pa、500℃和铁触媒催化的条件下,用氮气和氢气合成
D.在5×107Pa、500℃和铁触媒催化的条件下,用氮气和氢气合成
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com