
1.苯的同系物的概念
苯的同系物是指苯环上的 被 的产物。如甲苯(C7H8)、二甲苯(C8H10)等,故苯的同系物的通式为 。
2.苯的化学性质
苯分子中特殊的键决定了其化学性质的独特性:兼有 烃、 烃的性质。能发生 反应和 反应。
(1)取代反应:
①苯与溴的取代:化学方程式为 。

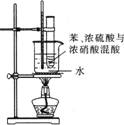
②苯与硝酸的取代:化学方程式为 。
(2)加成反应:
苯与H2的加成反应方程式为
(3)苯的燃烧反应方程式为 。
①因苯的含碳量 (与C2H2相同),苯在空气里燃烧时 ;②苯 被KMn04酸性溶液氧化,也 溴水反应(溴水中的溴可被
苯萃取)。
1.苯的结构
分子式:
结构式:
结构简式:
空间构型:
苯分子各个键之间的夹角都是 。虽然苯的结构式写成单、双键交替的环状结构,但苯分子里6个碳原子之间的键 。苯分子中六元环上的碳碳间的键是 键。
脂肪烃的来源有 等。石油中含有1-50个碳原子的 及 。石油通过常压分馏可以得到 等;而 可以得到润滑油、石蜡等相对分子质量较大的烷烃;通过石油的 及 可以得到较多的轻质油和气态烯烃,气态烯烃是最基本的化工原料;而 是获得芳香烃的主要途径。
天然气的化学组成主要是 ,以 为主(按体积分数计约占80%-90%)。天然气是 ,也是 。
煤也是获得有机化合物的源泉。通过煤焦油的分馏可以获得各种 ;
|

烷烃、烯烃、炔烃的结构、性质有何区别?
|
|
烷烃 |
烯烃 |
炔烃 |
|
|
通式 |
|
|
|
|
|
结构特点 |
|
|
|
|
|
代表物 |
|
|
|
|
|
主 要 化学性质 |
与溴(CCl4) |
|
|
|
|
与酸性高锰酸钾溶液 |
|
|
|
|
|
主要反应类型 |
|
|
|
|

1.乙炔
(1)乙炔的物理性质:乙炔是 的炔烃,是 的气体, 溶于水, 溶于有机溶剂。
(2)乙炔的分子组成与结构:分子式 ;结构式 ;结构简式 ;电子式 。
(3)乙炔的实验室制法:
主要化学反应原理: 。
(4)乙炔的化学性质 ‘
乙炔分子里碳碳三键中 个键较易断裂,这与乙烯分子相似。由此可知,乙炔与乙烯化学性质相似。
①乙炔的氧化反应
燃烧: 。
火焰明亮、带有浓烟,放出大量的热(火焰温度高达3 000℃以上)。经常利用氧炔焰来 ;
乙炔易被氧化剂氧化:使 溶液褪色。
②加成反应
与Br2的加成:使 或 溶液褪色.
 HC CH+Br2→
HC CH+Br2→
 HC CH +2Br2→
HC CH +2Br2→
与H2的加成:
 HC CH+H2→
HC CH+H2→
 HC CH+2H2→
HC CH+2H2→
与HCl的加成:
 HC CH+HCl→
(制塑料)
HC CH+HCl→
(制塑料)
3.顺反异构体的化学性质 ,物理性质 .
|

2.形成条件:一是具有 ,二是要求在组成双键的每个碳原子上必须连接 。
1.顺反异构:由于 而导致分子中 不同所产生的异构现象,称为顺反异构。
排列在 的称为顺式结构(如顺-2-丁烯);
分别排列在 的称为反式结构(如反-2-丁烯)。
1.2-加成:1,3-丁二烯分子中一个双键断裂。两个氢原子分别与
号碳原子和 号碳原子相连。化学方程式为 。
1,4-加成:l,3-丁二烯分子中两个双键断裂。两个氢原子分别
与 号碳原子和 号碳原子相连,在 号碳原子和 号碳
原子之间形成一个 。化学方程式为 。
1,3-丁二烯的1,2-加成和1,4一加成是竞争反应,到底哪一种加成占优势,取决于 。
|
|
2.烷烃、烯烃的化学性质
(1)烷烃的化学性质--与甲烷相似:一般比较稳定,在通常情况下跟酸、碱和酸性高锰酸钾等氧化剂 ,也不跟其他物质化合。但在特定条件下也能发生下列反应:① ;② (燃烧);③
(裂解反应)。
(2)烯烃的化学性质:烯烃的特征性结构是 ,它决定了烯烃的主要化学特征。性质类似乙烯。
①能使KMn04酸性溶液 。
②能燃烧,燃烧通式为 。
③加成反应,与 等加成。如:
CH2=CH-CH3+Br2→ 。
CH2=CH-CH3+HCl→ 。
④加聚反应,如丙烯加聚反应的化学方程式为:
。
⑤烯烃的1,2-加成与1,4-加成
1,3一丁二烯分子内含有两个双键。当它与一分子氯气发生加成反应时,有两种产物:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com