
20、配制500
mL 0.5 mol/L的NaOH溶液,试回答下列问题:
(1)计算:需要NaOH固体的质量为_________。
(2)某学生用托盘天平称量一个小烧杯的质量,称量前把游码放在标尺的零刻度处,天平静止时发现指针在分度盘的偏右位置,此时左边的托盘将(填“高于”或“低于”)右边的托盘。欲使天平平衡,所进行的操作为________。假定最终称得小烧杯的质量为____________(填“32.6 g”或“31.61 g”),请用“↓”表示在托盘上放上砝码,“↑”表示从托盘上取下砝码的称量过程,并在标尺上画出游码的位置(画“△”表示)。
|
砝码质量/g |
50 |
20 |
20 |
10 |
5 |
|
称量(取用砝码过程) |
|
|
|
|
|


(3)配制方法:设计五个操作步骤:
①向盛有NaOH的烧杯中加入200 mL蒸馏水使其溶解,并冷却至室温。
②继续往容量瓶中加蒸馏水至液面接近刻度线1-2 cm。
③将NaOH溶液沿玻璃棒注入500 mL容量瓶中。
④在烧杯中加入少量的蒸馏水,小心洗涤2-3次后移入容量瓶。
⑤改用胶头滴管加蒸馏水至刻度线,加盖摇匀。
试将以上操作排出先后顺序__________________________。
(4)某学生实际配制NaOH溶液的浓度为0.48 mol/L,原因可能是______________________。
A.使用滤纸称量氢氧化钠固体
B.容量瓶中原来存有少量蒸馏水
C.溶解后的烧杯未经多次洗涤
D.胶头滴管加水后定容时仰视刻度

19、某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。
已知该反应中H2O2只发生如下过程:H2O2→O2
(1)该反应中的还原剂是
。
(2)写出该反应方程式并配平
。
(3)如果反应转移了0.3 mol电子,则产生的气体在标准状况下的体积为
。

18、向100 mL FeBr2
溶液中通入标准状况下的 Cl2 3.36 L ,Cl2全部被还原,测得溶液中 c(Br-) = c(Cl-) ,则原 FeBr2 溶液的物质的量浓度是( )
A.0.75
mol/L B.1.5 mol/L C.2 mol/L
D.3 mol/L

第Ⅱ卷(共51分)
17、A实验室常用MnO2与浓盐酸共热制取Cl2,也可用KClO3,KMnO4,K2Cr2O7代替MnO2与浓盐酸反应制Cl2。若制取等量的Cl2电子转移数最少的是( )
A.KClO3和浓盐酸反应 B.MnO2和浓盐酸反应
C.KMnO4和浓盐酸反应 D.K2Cr2O7和浓盐酸反应
16、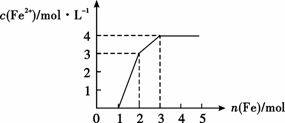 某稀溶液中含有Fe(NO3)3.Cu(NO3)2.HNO3,
某稀溶液中含有Fe(NO3)3.Cu(NO3)2.HNO3,
向其中逐渐加入铁粉,溶液中Fe2+的浓度(纵坐标)和加入铁粉的物质的量(横坐标)之间的关系入右图所示,则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )
A.1:1:1 B.1:3:1
C.3:3:8 D.1:1:4
15、向含有 的水溶液中,加入足量的
的水溶液中,加入足量的 固体,充分反应后再加入过量的稀盐酸,上述离子数目没有变化的是( )
固体,充分反应后再加入过量的稀盐酸,上述离子数目没有变化的是( )
A.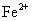 B.
B. C.
C.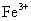 D.
D.

14、有一无色溶液,可能含有K+、Al3+、Mg2+、NH4+、Cl-、SO42-、HCO3-、MnO4-中的几种。为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气味和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生。下列推断正确的是( )
A、肯定有Al3+、Mg2+、NH4+、Cl- B、可能有K+、Cl-、MnO4-
C、肯定有Al3+、Mg2+、SO42- D、肯定有K+、HCO3-、MnO4-
13、常温时,某无色溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该无色溶液中一定大量共存的离子组是( )
A.AlO2-、K+、NH4+、Na+ B.I-、Ca2+、HCO3-、Na+
C.MnO4-、SO42-、K+、Al3+ D.Na+、SO42-、Cl-、NO3- 
12、下列各组离子一定能大量共存的是( )
A.在强碱溶液中:Na+、K+、CO32-、NO3-
B.在pOH=2的溶液中:NH4+、Na+、SO42-、AlO2-
C.在pH=1的溶液中:K+、Ag+、Mg2+、Fe2+
D.水电离出来的c(H+)=1×10-13 mol·L-1的溶液:K+、HCO3-、Br-、Ba2+
11、下列离子方程式中正确的是:( )
A.向碳酸氢钙溶液中加入过量氢氧化钠
Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
B.氧化铁可溶于氢碘酸:Fe2O3+6H+=2Fe3++3H2O
C.Fe3+的检验:Fe3++3SCN-=Fe(SCN)3↓
D.Na2S溶液呈碱性:S2-+H2O=HS-+OH-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com