
31.有一包固体粉末是Fe2O3和Al2O3的均匀混合物。
(1)取4.22g样品,加入某浓度的盐酸100mL,恰好完全反应,该盐酸的物质的量浓度范围是:_____________________.。
(2)配制该浓度的盐酸需37%密度为1.19g/cm3浓盐酸,浓盐酸的物质的量浓度为 。(保留2位小数)
(3)另 取4.22g样品,加入2.0
mol/ L盐酸90ml恰好完全反应,则n(Fe2O3)和n(Al2O3)的物质的量之比是
。
取4.22g样品,加入2.0
mol/ L盐酸90ml恰好完全反应,则n(Fe2O3)和n(Al2O3)的物质的量之比是
。
(4)另取2.11g样品,加入pH=0的硫酸150ml中,样品完全溶解。在反应后的溶液中,逐滴加入2mol/ L的NaOH溶液。
① 当滴入amL时,开始产生沉淀,则a mL。
②当生成沉淀的物质的量为0.025mol时,滴加氢氧化钠溶液的体积为 mL。
30.某工业废气经处理后的成分是 (含少量
(含少量 ),
),
(1)取该混合气体1升,通过排水集气,收集到0.4升气体。则原混合气体的平均摩尔质量为是___________。
(2)另取该混合气体11.2升(折算到标准状况),在催化剂作用下,用氨气来处理该气体,两者反应生成氮气和水,则需要氨气的物质的量是____________。
(3)另取该混合气体V升(折算到标准状况),通入盛有20.0g铜粉的反应器中,充分加热后生成氧化铜和氮气,粉末的质量变为21.92g。则原混合气的体积V为________(标准状况下)。
(1)丁子香酚的分子式为____________。
(2)丁子香酚不具有的性质是_________(选填序号)。
a.易溶于水 b.通常状况下呈固态
c.可发生消去反应 d.遇FeCl3溶液显紫色
(3)丁子香酚与浓溴水可以发生的反应是:__________________(填有机反应类型);
1 mol丁子香酚与浓溴水反应时,最多可消耗Br2__________mol。
(4)丁子香酚有多种同分异构体,写出符合下列要求的两个同分异构体的结构简式:
①苯环上的一氯取代物为两种; ②遇FeCl3溶液显色; ③能发生银镜反应
、
 。
。
29.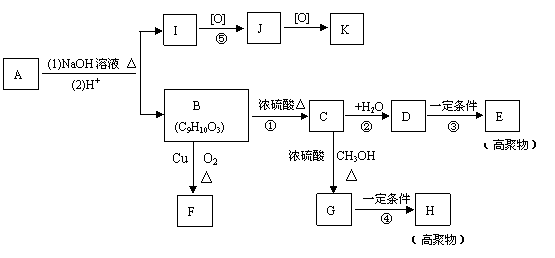 从有机化合物A出发,在一定条件下,可发生如下图一系列转化:
从有机化合物A出发,在一定条件下,可发生如下图一系列转化:
已知:B的苯环上只有一个侧链,并且不含甲基;B能与金属钠和NaHCO3溶液反应,与它们反应的物质的量之比分别为1:2和1:1;F、K都能发生银镜反应;B、D互为同分异构体。请完成下列各题:
(1)写出A和K的结构简式:
A: K:
(2) 写出反应类型:反应①
;反应③  。
。
(3) 写出反应②、④和⑤的化学方程式:
② 。
④ 。
⑤ 。
(4)B有多种同分异构体,写出一个除D外与B 同类别并且苯环上只有一个侧链
同类别并且苯环上只有一个侧链
的同分异构体 。
27.重晶石矿(主要成分为硫酸钡)因为含有Fe2O3、MnO 及炭质等杂质而常呈深褐色。工业上将重晶石矿粉碎后与硫酸、铝粉在反应槽中混合加热(即“漂白”),再经水洗等一系列工序制得白色的重晶石填料,广泛用作纸张、油漆等的填充剂。已知MnO是碱性氧化物,Al粉可以将深色的Fe3+转化为浅色的Fe2+。
及炭质等杂质而常呈深褐色。工业上将重晶石矿粉碎后与硫酸、铝粉在反应槽中混合加热(即“漂白”),再经水洗等一系列工序制得白色的重晶石填料,广泛用作纸张、油漆等的填充剂。已知MnO是碱性氧化物,Al粉可以将深色的Fe3+转化为浅色的Fe2+。
 重晶石填料的生产工艺流程为:
重晶石填料的生产工艺流程为:
(1)在该流程中,为加快“漂白”速度,采取的措施有 、 。
(2)硫酸起到了“漂白”的作用。请写出硫酸直接起到该作用时的化学方程式:
、 。
(3)二次漂白水洗过滤后,检验滤渣不含Fe2+离子的方法是
 。
。
(4)二次漂白前,煅烧的主要目的是 。
(5)将煅烧后的固体磨细,使用的是加有刚玉(氧化铝)球的振动磨。这说明刚玉具有很高的 。
(6)工业生产中为了充分利用资源,将滤液经过处理得到化工原料Fe2O3。操作过程是:
①通入过量氧化剂(Cl2),其目的是 。
②加入适量NaOH来调节溶液的pH ,其目的是
,
,其目的是
,
调节溶液的pH范围为 。
有关离子开始沉淀及完全沉淀时的pH如下:
|
离子 |
开始沉淀时的pH |
完全沉淀时的pH |
|
Fe2+ |
7.6 |
9.7 |
|
Fe3+ |
2.7 |
3.7 |
|
Al3+ |
3.8 |
4.7 |
|
Mn2+ |
8.3 |
9.8 |
③最后通过 、 、灼烧得到氧化铁。
26.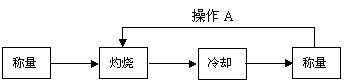 为测定碳酸钠的质量分数(设含杂质碳酸氢钠),某学生设计了如下两个实验方案,请回答每个方案中的问题。
为测定碳酸钠的质量分数(设含杂质碳酸氢钠),某学生设计了如下两个实验方案,请回答每个方案中的问题。
[方案Ⅰ] 重量法:
|
|
( 1)称量所需要的仪器是
。
1)称量所需要的仪器是
。
(2)样品放在 仪器中灼烧。
a.蒸发皿 b.烧杯 c.坩埚
(3)实验中操作A的名称为 。
(4)如果灼烧后的样品放在空气中冷却,会造成实验结果 (填“偏大”、“偏小”或“不变”)。
(5)样品碳酸钠的质量分数 。已知该样品碳酸钠的质量分数为0.913,则本次实验的相对误差为 。
[方案II] 滴定法:①称取样品 M g;②用amol/L 过量盐酸VmL在烧杯中溶解样品,并加水稀释配成100mL溶液;③取溶解后的溶液20.00mL,用bmol/L NaOH溶液滴定,恰好用去V,mL;④重复③的操作2~3次。
(6)配成上述溶液所需要的容器的名称是 。滴定中还需要的试剂是 。
(7)操作④的目的是 。
(8)滴定测得的过量盐酸中含HCl的总物质的量的表达式为 。
(9)下列操作会使过量盐酸中含HCl测定值偏小的是 。
a.盛放氢氧化钠的滴定管只用蒸馏水洗涤 b.滴定过程中有液体溅出
c.滴定中用蒸馏水冲洗锥形瓶内壁
(10)综上所述,你认为2个方案中,较好的方案是 。
25.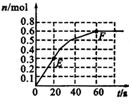 373 K时,某1 L密闭容器中发生如下可逆反应:A (g)
373 K时,某1 L密闭容器中发生如下可逆反应:A (g) 2B (g)。其中物质B的物质的量变化如右图所示。
2B (g)。其中物质B的物质的量变化如右图所示。
(1)已知373 K时60 s达到平衡,则前60 s内A的平均反应速率为 。
(2)该反应的平衡常数表达式为 。
(3)若在此平衡体系中再加入amol的A,反应速率
(填“增大”或“减小”,下同),平衡时A的转化率 。A的平衡浓度 。
(4)若373 K时B的平衡浓度为A的2倍,473 K时(其他条件不变),B的平衡浓度为A的3倍,该反应的正反应为 (填“放热反应”或 “吸热反应”),为使该反应的平衡常数变小,可以采取的措施是 。
a.升高温度 b.扩大容器的体积
c.降低温度 d.将B从体系中抽走
(4)若反应在373 K进行,在甲、乙两容器都为1 L密闭容器,分别加入1 mol B;1 mol B、0.2 mol He,达到平衡时B的转化率应 。
a.甲>乙 b.乙>甲 c.甲=乙 d.无法确定
24.高锰酸钾在不同的条件下发生还原反应如下:
MnO4- + 5e + 8H+ → Mn2+ + 4H2O MnO4- +3e + 2H2O → MnO2↓+ 4OH-
MnO4- + e → MnO42- (溶液绿色)
(1)从上述三个半反应中可以看出高锰酸根离子还原产物受到溶液的 影响。
(2)将SO2通入高锰酸钾溶液中,发生还原反应的离子反应过程为 → 。
(3)将PbO2投入到MnSO4酸性溶液中搅拌溶液变为紫红色。下列说法正确的是( )。
a.氧化性:PbO2>KMnO4 b.还原性:PbO2>KMnO4 c.该反应可以用盐酸酸化
(4)将高锰酸钾逐滴加入到硫化钾溶液中发生如下反应,其中K2SO4和S的物质的量比为3:2。完成下列化学方程式,并标出电子转移的方向和数目。
KMnO4 + K2S + → K2MnO4 + K2SO4+ S↓+
若生成5.44g单质硫,反应过程中转移的电子数约为 ;若反应中有22mol电子转移,则生成K2SO4和S的物质的量比为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com