
25.运用化学反应原理研究元素的单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡
移动(填“向左”、“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡
移动(填“向左”、“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。
(2)甲烷在高温下与水蒸气反应生成CO和H2。已知部分物质燃烧的热化学方程式如下:
2H2(g )+O2(g)=2H2O(l) △H=-571.6kJ·mol-1
)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H=-566kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ·mol-1
又知1molH2O(g)转变为1mol H2O(l)时放出44.0kJ热量。写出CH4和水蒸气在高温下反应的热化学方程式 。
(3)已知25℃时Ksp[Mg(OH)2]=1.8×10-11 mol3·L-3,KsP[Cu(OH)2]=2.2×10-20mol3·L-3。在25℃下,向浓度均为0.1mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成___ _ 沉淀(填化学式),生成该沉淀的离子方程式为 __ _____。
如要使0.022mol·L-1的CuSO4溶液里的Cu2+生成Cu(OH)2沉淀,则应调整溶液的pH使之大于 。
(4)已知饱和CO2溶液中c(CO32-)=5.6×10-11mol·L-1,KSp(CaCO3)=2.8×10-9mol2·L-2。向1.0mol·L-1的CaCl2溶液中通入CO2气体直至饱和,能否得到CaCO3沉淀? ,理论依据是
(通过计算加以说明)。
(5)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造新型燃烧电池。请写出该电池的正极反应式 。
(6)某温度时,测得0.01mol·L-1的NaOH溶液的pH=11。在此温度下,将pH=a的H2SO4溶液VaL与pH=b的NaOH溶液VbL混合,若所得混合液为中性,且a+b=12,则:Va︰Vb= 。
(7)在25℃下,将a mol·L-1的醋酸与0.01 mol·L-1的氢氧化钠溶液等体积混合,反应平衡时溶液中c(Na+)=c(CH3COO-)。则溶液显________性(填“酸”“碱”或“中”), a 0.01(填“大于”、“小于”或“等于”);用含a的代数式表示醋酸(HAc)的电离常数为Ka=______ ___。
24.能源短缺是人类面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I:CO(g)+2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II:CO2(g)+3H2(g) CH3OH(g)+
H2O(g) ΔH2
CH3OH(g)+
H2O(g) ΔH2
①上述反应符合“原子经济”原则的是 (填“I”或“Ⅱ”)。
②下表所列数据是反应I在不同温度下的化学平衡常数(K)。
|
温度 |
250℃ |
300℃ |
350℃ |
|
K |
2.041 |
0.270 |
0.012 |
由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol/L,则CO的转化率为 ,此时的温度为 (从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH=-1275.6 kJ/mol
② 2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ/mol
③ H2O(g)=H2O(l) ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
。
 (3)某实验小组依据甲醇燃烧的反应原理,设计如右图所示的电池装置。
(3)某实验小组依据甲醇燃烧的反应原理,设计如右图所示的电池装置。
① 该电池正极的电极反应为 。
② 工作一段时间后,测得溶液的pH减小,该电池总反应的离子方程式为
。
23.短周期主族元素A、B、C、D、E的原子序数依次增大,它们的原子核外层数之和为10;B的化合物种类繁多,数目庞大。C、D是空气中含量最多的两种元素;D、E两单质可以生成两种不同的离子化合物。
(1)写出E的单质与A、D两元素形成的常见化合物反应的离子方程式___ _。
(2)由A、C、D三元素所形成的共含有9个原子的常见化合物的溶液呈_________性(填“酸”、“中”、“碱”),该溶液中离子浓度大小的排列顺序是 _______ _______________。
(3)B的相对分子质量最小的氢化物的燃烧热为890.3 kJ·mol-1,写出其燃烧的热化学方程式:
___________________________________________________________。
该氢化物与D的单质在碱性介质中可以形成燃料电池,写出该燃料电池的负极上发生反应的电极反应式______ ______________。
(4)X、Y是均由C、D两元素组成的化合物,且C、D在X、Y中的价态相同,某温度下相互转化时的量变关系如右图。则:
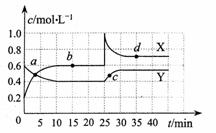 X的化学式是______________,
X的化学式是______________,
图中a、b、c、d四点中,表示反应υ正 υ逆 的是___ __,
υ逆 的是___ __,
该温度下,反应Y转化为X的平衡常数为______ _____,
反应进行到25min时,改变的条件可能是______________。
(5)现有由A、B、D、E四种元素中的三种组成的0.1mol·L-1某正盐溶液, 你认为该溶液呈碱性的原因是(用离子方程式表示):___________________________;为证明你的上述观点,请设计一个简单的实验,简述实验过程:_________________ _________
_ 。
某同学认为该正盐溶液中的水解是微弱的,发生水解的BD32-离子不超过其总量的10%。请你设计实验证明该同学的观点是否正确_____________________ _
_________ _____。
22.I.氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:
2NO3-+10H++8e-→N2O+5H2O。Fe2(SO4)3、KMnO4、Na2CO3、FeSO4四种物质中的一种物质能使上述还原过程发生。
(1)写出该氧化还原反应的化学方程式: (不配平)。
(2)该反应中氧化剂和还原剂物质的量之比为 。
(3)反应中硝酸体现了 、 性质。
(4)反应中若产生0.1mol气体,则转移电子的物质的量是 。
Ⅱ.已知:Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10。工业上制备BaCl2的工艺流程图如下:
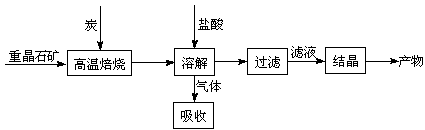
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s)+4C(s)=4CO(g)+BaS(s) △H1=571.2 kJ·mol-1 ①
BaSO4(s)+2C(s)=2CO2(g)+BaS(s) △H2=226.2 kJ·mol-1 ②
(1)气体用过量NaOH溶液吸收得Na2S,Na2S水解的离子方程式: ,
写出Na2S溶液中的电荷守恒关系 。
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,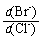 = 。
= 。
(3)反应C(s) + CO2(g)=2CO(g)的△H= kJ·mol-1。
(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是:
;
。
21.A-J分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。请填写下列空白:
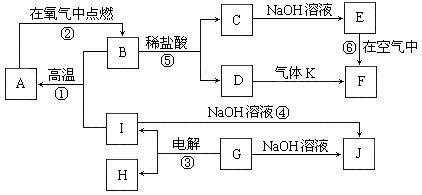
(1)A、B、C、D、E、F六种物质中的含有同一种元素在周期表中位置 ,
(2)写出检验D溶液中阳离子的方法 。
(3)写出反应④的离子方程式 。
写出引发反应①的实验操作 ,
指出该反应一种重要的工业用途 。
(4)若28gA单质在足量的氧气中灼烧,反应放出的热量为QkJ(Q>0),写出这个反应的热化学方程式: ;
(5)25℃下,若向气体K的水溶液中加入盐酸,使其恰好完全反应,所得溶液的pH<7,用离子方程式表示其原因: ;若向气体K的0.1mol/L水溶液中加入pH=1的硫酸,且二者的体积比为1:1,则所得溶液中各离子物质的质量浓度由大到小的关系是 。
20.某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。
甲同学认为两者反应生成只有CuCO3一种沉淀;
乙同学认为这两者相互促进水解反应,生成Cu(OH)2一种沉淀;
丙同学认为生成CuCO3和Cu(OH)2两种沉淀。(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)
Ⅰ.按照乙同学的理解Na2CO3溶液和CuSO4溶液反应的化学反应方程式为
;
在探究沉淀物成分前,须将沉淀从溶液中分离并净化。具体操作为:
①过滤,②洗涤,③干燥。
Ⅱ.请用下图所示装置,选择必要的试剂,定性探究生成物的成分。

(1)各装置连接顺序为 → → 。
(2)装置C中装有试剂的名称是 。
(3)能证明生成物中有CuCO3的实验现象是 。
Ⅲ.若CuCO3和Cu(OH)2两者都有,可通过下列所示装置的连接,进行定量分析来测定其组成。

(1)各装置连接顺序为 → → → →E。
(2)装置C中碱石灰的作用是 ,实验开始时和实验结束时都要通入过量的空气其作用分别是
。
(3)若沉淀样品的质量为m克,装置B质量增加了n克,则沉淀中CuCO3的质量分数为:
。
19.(1)玻璃棒是中学化学实验中常用的仪器。下列过程中,一般不需要玻璃棒的是 (填写编号)
①用pH试纸测定Na2CO3溶液的pH
②配制一定物质的量浓度的氯化钠溶液
③将适量氯化铁饱和溶液滴入沸水中制备氢氧化铁胶体
④探究Ba(OH)2·8H2O晶体和NH4Cl晶体反应过程中的能量变化。
⑤实验室用新制备的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
(2)用“大于”“等于”“小于”填空
①读量筒中液体的体积时,视线偏高,读取的体积数 实际体积数
②用托盘天平称取10.4g食盐,将砝码和食盐的位置颠倒,所称食盐的质量 10.4g
③配制500ml 0.1mol/lNaOH溶液,定容时俯视刻度线,所得溶液的物质的量浓度 0.1mol/l
④用中和滴定法测某NaOH溶液的浓度,量取待测液未用该溶液润洗滴定管,测得的溶液的浓度 实际浓度
(3)用下图所示装置完成下列实验(图中夹持装置已略去):用装置A由浓硫酸和亚硫酸钠固体制取SO2气体,并通过装置B完成下表中设计的实验,尾气可用NaOH溶液吸收。

|
B中棉花的位置 |
① |
② |
③ |
④ |
|
所蘸试剂 |
石蕊试液 |
品红溶液 |
淀粉和碘水混合液 |
氢硫酸 |
|
现象 |
|
|
褪色 |
浅黄色 |
|
体现SO2的性质 |
水溶液显酸性 |
漂白性 |
|
氧化性 |
请填写上表中的空白并回答:
仪器P的名称是 ;
③中反应的离子方程式为: ;
用过量NaOH溶液吸收尾气的离子方程式为 。
18.锌与100 mL 18.5 mol·L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体甲33.6L(标准状况)。将反应后的溶液稀释至1L,测得溶液的pH=1,下列叙述不正确的是
A.反应中共消耗1.8 mol H2SO4 B.气体甲中SO2与H2的体积比为4:1
C.反应中共消耗97.5 g Zn D.反应中共转移3 mol电子
17.25℃时,有关弱酸的电离平衡常数如下:
|
弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
|
电离平衡常数(25℃) |
1.8×l0-5 |
4.9×l0-10 |
K1=4.3×l0-7
K2=5.6×l0-11 |
下列有关说法正确的是
①等物质的量浓度的各溶液pH关系为:pH(CH3COONa)>pH(Na2CO3)>pH(NaCN)
②a mol·L-1 HCN溶液与b mol·L-1 NaOH溶液等体积混合后,所得溶液中:c(Na+)>c(CN-),则a一定大于b
③冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离程度、pH均先增大后减小
④NaHCO3和Na2CO3混合溶液中,一定存在c(Na+)+ c(H+)=c(OH-)+ c(HCO3-) +2c(CO32-)
⑤等浓度的CH3COONa、NaCN、Na2CO3混合溶液中 :
:
c(CH3COO-)>c(CN-)>c(CO32-)>c(OH-)
A.①② B.③⑤ C.④⑤ D.②④
16.我国著名化学家徐光宪因在稀土元素研究领域作出突出贡献荣获2008年“国家最高科学技术奖”。稀土元素铈(Ce)主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法正确的是
A.电解熔融CeO2制Ce,铈在阳极获得
B.铈溶于氢碘酸的化学方程式可表示为:Ce+4HI=CeI4+2H2↑
C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+=Ce3++2Fe3+
D.四种稳定的核素136 58Ce、138 58Ce、140 58Ce、142 58Ce,它们互称为同位素
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com