
25.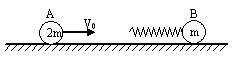 (20分)
(20分)
(1)弹簧压缩至最短时,A、B速度均
为v,选取向右为正,根据动量守恒定律,有:
 3分
3分
根据机械能守恒定律,有:

 3分
3分
(2)设B球与挡板碰撞时,A球速度为v1、B球速度为v2(均向右)
根据动量守恒定律: --① 2分
--① 2分
此时弹簧弹性势  3分
3分
则B球与挡板刚碰后:A球速度为v1、 B球速度为-v2(向左),此后
弹簧压缩至最短时共同速度为v3,则:
 --② 2分
--② 2分
此时弹簧弹性势能 
 2分
2分
由题意:  得
得 --③ 3分
--③ 3分
由①②③式可得: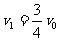
 2分
2分
宝鸡中学2010届高三月考(一)
24.(18分)
解:(1)油滴M带正电,在两金属板之间处于平衡,则B板电势较高, 2分
由平衡得:  可得两板电压:
可得两板电压: 2分
(2)设油滴N带电量为Q,油滴N与M相碰前的瞬间速度为v0,有:
2分
(2)设油滴N带电量为Q,油滴N与M相碰前的瞬间速度为v0,有:
 3分
3分
油滴N能与M相碰应有: > 0
> 0 
求得电量:
Q < 3q 2分

油滴N和M相碰后,结合成大油滴,设速度为v ,有
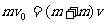 2分
2分
可得:
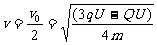 2分
2分
此后,大油滴向下运动,不碰到B板,有
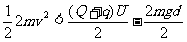

代入v和U的值,解得: 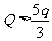 3分
3分
所以油滴所带电量的范围是: 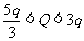 2分
2分
23.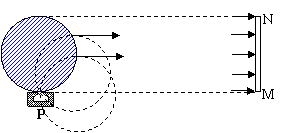 (18分)(1)匀强磁场的方向为垂直纸面向外
3分
(18分)(1)匀强磁场的方向为垂直纸面向外
3分
 (2)最小有界磁场如图所示, 4分
(2)最小有界磁场如图所示, 4分
(3)要想使所有的粒子都最终水
平向右运动,带电粒子在磁场中
做匀速圆周运动的轨道半径必须
与最小圆形有界匀强磁场的半径
大小一致所以有:R=L/2 2分
根据牛顿第二定律: 得:
得: 3分
联立解得:
3分
联立解得: 3分
3分

如图所示,有界磁场的最小面积为:S=πL2/4 3分
14.(12分) (1)由于小灯泡灯丝的电阻值远小于电压表的内阻(如:电压为2.00V
时,其阻值R灯= ),为减少由于电表接入电路引起的系统误差,应采
),为减少由于电表接入电路引起的系统误差,应采
用电流表外接法.为使小灯泡两端的电压的变化范围尽可能大,滑线变阻器应连接成分
压电路,实验电路如图所示. 4分
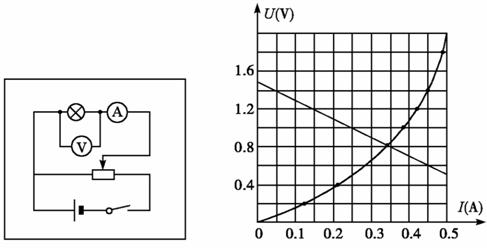


(2)根据实验得到的数据在U-I坐标系中描点,并将这些数据点连接成一条平滑的曲
线,如图所示.(如果不是平滑的曲线,不得分)
4分
(3)作出电源的U-I图线,它与小灯泡的伏安特性曲线的交点坐标就是小灯泡的工作
点,小灯泡的实际功率P=IU=0.27-0.28W(在此范围内都给分).(没有画出电源的 U-I
图线,不得分;图像正确,但功率计算错误的得2分)

22.(1)
1.880 4分
31、Ⅰ(18分)下图是人体内以丙酮酸为中心的代谢途径,A、B、C、D代表不同物质;①-⑩代表生理过程,请据图回答下列问题:

(1)B、C物质分别是 和 。
(2)⑦过程发生在 中,试写出葡萄糖经③⑦过程生成D物质的化学反应式
。若D物质在人体内增多时,参与调节内环境稳态的主要物质是 。
(3)过程⑤在人体内 时会加强。
Ⅱ、(12分)下图为吞噬细胞杀灭细菌的示意图,图中的溶酶体内含有多种水解酶,据图回答:
(1)图中①过程进行的是溶酶体释放水解酶,将细菌分解,该过程属于 免疫。
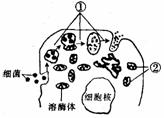 (2)有些毒性很强的细菌经过上述过程虽然还不能被清除,但其内部隐藏的
可以被暴露出来,呈递给相应的免疫细胞,使之迅速增殖分化成
。当该细菌在体液中活动时,会被相应的抗体消灭,这属于特异性免疫中的
。
(2)有些毒性很强的细菌经过上述过程虽然还不能被清除,但其内部隐藏的
可以被暴露出来,呈递给相应的免疫细胞,使之迅速增殖分化成
。当该细菌在体液中活动时,会被相应的抗体消灭,这属于特异性免疫中的
。
理综·物理部分答案
选择题
A卷:14.AB
15.B 16.B 17.AC 18.B 19.C 20.C 21.B
B卷:14BC
15.D 16.D 17.BC 18D
19.C 20.A 21A
30.回答下列与细胞有关的实验问题。(12分)
(1)下列4项实验中,需保持细胞生理活性的有__________(填序号)。
①观察叶绿体和原生质的流动
②观察洋葱鳞片叶内表皮细胞中DNA的分布
③探究酵母菌的呼吸方式
④红细胞中血红蛋白的提取和分离
(2)按下面步骤进行质壁分离实验。
步骤一:在洁净的载玻片中央加一滴清水,取一片藓类小叶,盖上盖玻片。
步骤二:从盖玻片一侧滴入0.3g/mL的蔗糖溶液,在盖玻片的另一侧用吸水纸吸引。这样重复几次,使盖玻片下面的藓类小叶浸润在0.3/mL的蔗糖溶液中。
步骤三:在显微镜下观察,结果如图27-1所示。
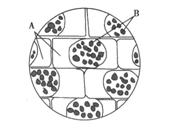
图27-1
①图27-1中A、B处的颜色分别是__________。
②如果上述实验步骤二中从盖玻片的一侧滴入的是加有伊红(植物细胞不吸收的红色染料)的0.3g/mL的蔗糖溶液,则在显微镜下观察到A、B处颜色分别是_______________________。
③如果将步骤二中浸润在0.3g/mL的蔗糖溶液中的藓类小叶的装片,放在80℃条件下处理一段时间(装片中的藓类小叶保持在0.3/mL的蔗糖溶液中)。在显微镜下清晰地观察到细胞结构后,为更准确地判断A处颜色,对显微镜的操作方法是____________________、________________________________________。
如果A处呈绿色,可能的原因是________________________________________。
29.(15分)
(1)下列物质属于非电解质的是 ,属于弱电解质的是
①氨水 ②SO2 ③CI2 ④甲酸 ⑤BaSO4 ⑥CH3CH2OH ⑦H2O ⑧NaHCO3
(2)将浓度均为2mol·L-1的AgNO3与Cu(NO3)2溶液各0.5L混合,以铜为电极进行电解一段时间之后,阴极上有1.6g铜析出.
回答下列问题:
①阴极上是否有银析出? (填“有”或“没有”).若有,析出银的质量为 g
②直流电源已输出 mol电子.
③溶液中Cu2+的物质的量浓度为 mol·L-1
28.(15分)实验室里临时需要用NaOH溶液和CO2来制取纯Na2CO3溶液.已知CO2气体通入NaOH溶液过程中极易过量生成NaHCO3,且无明显现象.
实验室有下列试剂:①未知浓度的NaOH溶液;②37﹪的盐酸;③37﹪的硫酸;④14﹪的盐酸;⑤大理石;⑥K2CO3固体;⑦碱式碳酸铜.
实验室有以下仪器:铁架台,启普发生器,量筒,烧杯,橡皮管,玻璃导管,分液漏斗.已知下表中各物质在常温时的溶解度(g/100g·H2O)
|
Na2CO3 |
NaHCO3 |
NaCl |
Na2SO4 |
NaHSO4 |
NaOH |
|
15.9 |
8.4 |
35 |
35.5 |
20 |
40 |
⑴.实验应选用的仪器:除启普发生器,橡皮管,玻璃导管外,还需要: .
⑵.为了保证制得的Na2CO3溶液尽量纯,应选用的药品(填编号):除①外,还需要: .
⑶.简要叙述实验步骤,直到制得纯Na2CO3溶液(仪器安装可省略).
.
⑷.据实验给出的溶解度表,求出当NaOH溶液中溶质的质量分数大于多少时,在通入CO2过程中会有晶体析出(写出计算步骤和必要的文字说明)?
27.(15分)卤代烃R-Cl在一定条件下可发生如下反应:R-Cl+KCN→R-CN+KCl;
R-CN+2H2O+H+→R-COOH+NH4+ ,以乙烯为原料经过下图所示的反应可制取有机物w(A、B、C、D、E均为烃的衍生物)
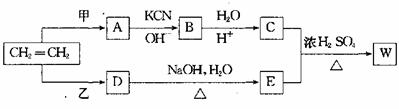
(1)若甲为Cl2,乙为HCl,A和D两种物质的关系是
①同一物质 ② 同系物 ③ 同分异构体 ④ 以上都不对
(2)若甲为HCl,乙为Cl2,生成物W的分子式为C5H10O3,则W的结构简式为 。
(3)若甲为Cl2,乙为Br2 。按下列要求写出C+E→W的化学方程式:
①W为最小环状分子 。
②W为高分子 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com