
4、 两极格局的形成:“冷战”局面的形成;德国、朝鲜的分裂和古巴导弹危机。
3、“一国两制”的理论与实践:“一国两制”的构想;香港、澳门的回归;海峡两岸关系的发展。
1、中华人民共和国的成立与民主政治制度的建设:中华人民共和国的成立;中国共产党领导的多党合作和政治协商制度的形成;人民代表大会制度的创立;民族区域自治制度的建立。
20.(12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选择其中一题作答。若两题都做,则按A题评分。
A.微粒A、B、C为分子,D和F为阳离子,E为阴离子,它们都含有l0个电子;B溶于A后所得的物质可电离出D和E;C是重要的化石能源。将A、B和含F离子的物质混合后可得D和一种白色沉淀。G3+离子与Ar原子的电子层结构相同。请回答:
(1)基态G原子的外围电子排布式是 。在A、B、C这三种分子中,属于非极性分子的有
(写化学式)。
(2)下列有关B的说法中正确的是 。(填字母)
a.在配合物中可作为配体 b.该分子的稳定性与氢键有关
c.分子中各原子最外层均为8e-的稳定结构 d.含1 molB的液体中有3mol氢键
 (3)根据等电子体原理,D离子的空间构型是 ,其中心原子轨道的杂化类型是
。
(3)根据等电子体原理,D离子的空间构型是 ,其中心原子轨道的杂化类型是
。
(4)构成C的中心原子可以形成多种单质,其中有一种为空间网状结构,右图立方体中心的“●”表示该晶体中的一个原子,请在该立方体的顶点上用“●”表示出与之紧邻的原子。
(5)光谱证实F与烧碱溶液反应有Na[F(OH)4]生成,则Na[F(OH)4]中不存在 。(填字母)
a.金属键 b.离子键 c.非极性键 d.极性键 f.配位键 g. 键 h.
键 h. 键
键
B.对氨基苯磺酸是制取某些染料和药物的重要中间体,可由苯胺磺化得到:


实验室可用苯胺、浓硫酸为原料,利用右图所示实验装置合成。
实验步骤如下:
①取一个250 mL的仪器a,加入10 mL苯胺及几粒沸石,放入冷水中冷却,小心地加入18 mL浓硫酸。再分别装上冷凝管、温度计等。
②将a置于油浴中缓慢加热至l70 -180℃,维持此温度约2.5 h。
③将反应产物冷却至约50℃后,倒入盛有l00 mL冷水的烧杯中,用玻璃棒不断搅拌,促使晶体析出。用该烧杯中的少量冷水将a内残留的产物冲洗到烧杯中,抽滤,用少量冷水洗涤,得到粗产品。
④将粗产品用沸水溶解,冷却结晶(若溶液颜色过深,可用活性炭脱色),抽滤,收集产品,晾干。(提示:100 mL水在20℃时可溶解对氨基苯磺酸1.089,在100℃时可溶解6.67g)
(1)仪器a的名称是 。步骤①中加入沸石的作用是 。
(2)步骤②中采用油浴加热,下列说法正确的是 。(填字母)
A.便于控制温度 B.也可以改用水浴加热 C.温度计的水银球也可浸在油中
(3)步骤③用冷水洗涤的优点是 。
(4)步骤③和④均进行了抽滤操作,在抽滤完毕停止抽滤时,应注意先 ,然后 。
(5)步骤④有时需重复进行多次,其目的是 。
徐州市2009--2010学年度高三第三次调研考试
19.(10分)硫酸在生产中有广泛的应用,某厂以硫铁矿为主要原料生产硫酸。

已知:①550℃时,2S02(g)+02(g)
2S03(g) 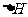 =一196.6 kJ·mol-1。
=一196.6 kJ·mol-1。
②一定温度下,硫铁矿在空气中煅烧可能发生下列反应(设空气中N2与O2的体积比为4:1):3FeS2+802=Fe304+6S02,4FeS2+1102=2Fe203+8S02。
(1)550℃时,6.4g S02(g)与足量O2(g)充分反应生成S03(g),放出热量 9.83 kJ
(填“大于”、“等于”或“小于”)0 、
(2)欲使反应①的平衡向正反应方向移动,下列措施可行的是 。(填字母)
 a.向平衡混合物中充入Ar b.向平衡混合物中充入02
a.向平衡混合物中充入Ar b.向平衡混合物中充入02
c.改变反应的催化剂 d.降低反应的温度
(3)为使FeS2完全生成Fe203,生产时要使用过量的空气,则当空气过量50%时,所得炉气中S02的体积分数是多少?
(4)720g纯净的FeS2在空气中完全煅烧,所得固体中Fe和O的物质的量之比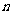 (Fe):
(Fe):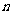 (O)=6:
(O)=6: ,此时消耗空气为
,此时消耗空气为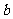 mol。
mol。
①试写出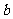 与
与 的关系式:
。
的关系式:
。
②请在右图中画出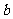 与
与 的关系曲线。
的关系曲线。
18.(12分)化合物G是中药黄芩中的主要活性成分之一,具有抗氧化和抗肿瘤作用。G的合成路线如下:
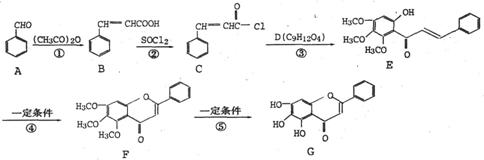
请回答下列问题:
(1)G中含有的含氧官能团的名称有 。
(2)反应③为取代反应,D的结构简式是 ,D分子中含有 种不同化学环境的氢原子。
(3)同时符合下列a、b、C三个条件的B的同分异构体共有 种。
a. 能发生银镜反应; b.屑于苯的衍生物,苯环上共有3个链状取代基;
c.能与FeCl3溶液发生显色反应
(4)反应⑤的反应类型是 。在反应①中,反应物的物质的量之比为1:1,反应的化学方程式如下:

若M呈酸性,则其结构简式是 。

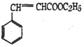
(5)已知 可作为果味香精。请设计合理方案以 、CH3CH20H为原料合成

(用合成路线流程图表示,并注明反应条件)o

②合成过程中无机试剂任选;③合成路线流程图示例如下:

17.(10分)近年,我国在航天事业上取得了令世界瞩目的成就,神舟飞船多次被长征系列火箭送入太空。
(1)长征二号捆绑式火箭推进剂以联氨(N2H4)作为燃料,N204作为推进剂。
①N204的主要作用是助燃,但其在工作时会产生红棕色气体N02,对环境会造成污染,为避免污染可使用下列 (填字母)代替之。
A.液态氨 B.H202 C.KMn04 D.液态氧
②在碱性条件下,用尿素[CO(NH2)2]和次氯酸钠反应可以制取联氨(产物中同时有两种正盐),则该反应的离子方程式是 。
(2)飞船座舱内空气的更新过程如下图所示:

①座舱内空气更新过程可以循环利用的物质为H2、O2和 ;装置Ⅱ中发生反应的化学方程式为 。
②从装置Ⅰ、Ⅱ、Ⅲ可看出O2的来源,若宇航员每天消耗35 mol02,每天呼出的气体中含18 mol H20,则呼出的气体中含C02 mol。
16.
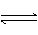 (10分)大气固氮属于自然固氮,合成氨是目前人工固氮的主要方法。科学家一直致力“人工固氮”新方法的研究。
(10分)大气固氮属于自然固氮,合成氨是目前人工固氮的主要方法。科学家一直致力“人工固氮”新方法的研究。
(1)有关大气固氮(以N2+02
2N0为例)、人工固氮(以N2+3H2 2NH3为例)反应的平衡常数 的值如下表。
的值如下表。
|
反应 |
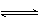 N2+02
2NO N2+02
2NO
|
 N2+3H2 2NH3 N2+3H2 2NH3 |
||
|
温度/℃ |
27 |
2000 |
100 |
400 |
|
K |
3.84×10-31 |
0.1 |
3.4×109 |
2.0x104 |
下列说法正确的是 。(填字母)
a.大气固氮与人工固氮都是放热反应 b.人类模拟大气固氮无现实意义
c.寻找在常温下合成氨的高效催化剂是目前人工固氮的新方向
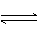 d.在常温下,人工固氮非常容易进行
d.在常温下,人工固氮非常容易进行
(2)已知:N2(g)+3H2(g) 2NH3(g) 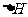 =-92.4kJ·mol-1
=-92.4kJ·mol-1
2H2(g)+02(g)=2H20(1)
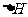 =-571.6 kJ·mol-1
=-571.6 kJ·mol-1
据报道,在常温、常压、光照、催化剂的条件下,N2可以与水反应,则反应
 N2(g)+3H20(1)=2NH3(g)+3/2O2(g)的
N2(g)+3H20(1)=2NH3(g)+3/2O2(g)的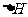 =
KJ·mol-1。
=
KJ·mol-1。
 (3)某研究小组在673 K、30 MPa下,在体积为
(3)某研究小组在673 K、30 MPa下,在体积为 的密闭容器中进行反应:N2(g)+3H2(g) 2NH3(g),其
的密闭容器中进行反应:N2(g)+3H2(g) 2NH3(g),其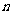 (H2)和
(H2)和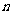 (NH3)随时间变化的关系如图所示。
(NH3)随时间变化的关系如图所示。
①下列叙述正确的是 。(填字母)
A.点a的正反应速率比点b的大
B.点c处反应达到化学平衡状态
C.若t3时由673 K升至773 K,则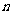 (H2)将增大
(H2)将增大
②从开始到平衡时反应的平均速率(以H2的浓度变化表示) (H2)=
。
(H2)=
。
③若开始时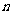 (N2)=
(N2)=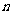 (H2),则反应的平衡常数
(H2),则反应的平衡常数 =
(用代数式表示)。
=
(用代数式表示)。
15.(10分)重铬酸钠(Na2Cr207)广泛用作氧化剂、鞣革剂等。以铬矿石(主要成分为Cr203,还含 有Fe0、Al203、Si02等杂质)为原料制取重铬酸钠的流程如下:

请回答下列问题:
(1)Cr203在高温焙烧时反应的化学方程式为 。
 (2)生产过程中,调节(含Na2Cr04、Na2Si03、NaAlO2的溶液)pH的目的是
。
(2)生产过程中,调节(含Na2Cr04、Na2Si03、NaAlO2的溶液)pH的目的是
。
(3)某化工厂采用石墨作电极电解Na2Cr04溶液,实现了Na2Cr04转化为Na2Cr207的生产,其原理如右图所示。
①写出阳极的电极方程式: ;
②此生产方法和上述流程相比的优点主要有 。
(4)Na2Cr207可用于测定废水的化学耗氧量(即COD,指每升水样中还原性物质被氧化所需要的02的质量)。现有某水样100.00 mL,酸化后加入 mo1/L的Na2Cr207溶液
mo1/L的Na2Cr207溶液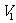 mL,使水中的还原性物质完全被氧化(还原产物为Cr3+);再用
mL,使水中的还原性物质完全被氧化(还原产物为Cr3+);再用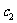 mol/L的FeS04溶液滴定剩余的Cr2072-,结果消耗FeS04溶液
mol/L的FeS04溶液滴定剩余的Cr2072-,结果消耗FeS04溶液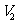 mL。则该水样的COD为
mg/L
mL。则该水样的COD为
mg/L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com