
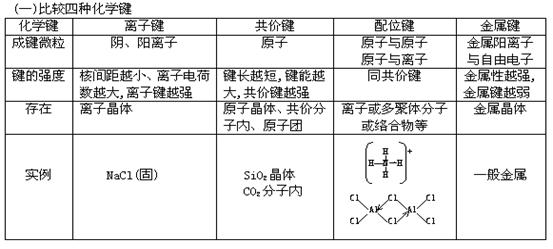
Ge
 分子的空间构型与键的极性和分子的极性
分子的空间构型与键的极性和分子的极性
4、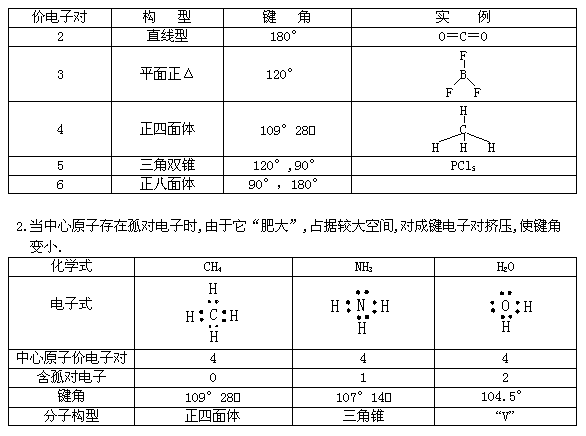 价电子对、键角与分子的构型:
价电子对、键角与分子的构型:
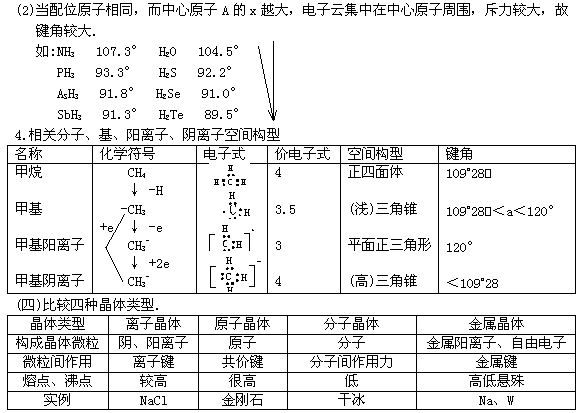 (二)如何比较物质的熔、沸点
(二)如何比较物质的熔、沸点
3. 电子数和核电荷数都不同的微粒:
(1)同主族的元素,无论是金属还是非金属,无论是原子半径还是离子半径从上到下递增.
(2)同周期:原子半径从左到右递减.如Na>Cl
(3)同周期元素的离子半径比较时要把阴阳离子分开.同周期非金属元素形成的阴离子半径大于金属元素形成的阳离子半径.如Na+<Cl- 如:第三周期,原子半径最小的是Cl, 离子半径最小的是Al3+
(4)如既不是同周期,又不是同主族,比较原子半径时,要寻找到合适的中间者.
如Ge、P、O的半径大小比较,可找出它们在周期表中的位置,( )中元素为中间者.
(N) O
2. 电子数相同的微粒,核电荷数越多则半径越小.即具有相同电子层结构的微粒,
核电荷数越大,则半径越小.如:
(1)与He电子层结构相同的微粒: H->Li+>Be2+
(2)与Ne电子层结构相同的微粒: O2->F->Na+>Mg2+>Al3+
(3)与Ar电子层结构相同的微粒: S2->Cl->K+>Ca2+
无论是原子还是离子(简单)半径,一般由原子核对核外电子的吸引力及电子间的排斥力的相对大小来决定.故比较微粒半径大小时只需考虑核电荷数、核外电子排斥情况.具体规律小结如下:
1. 核电荷数相同的微粒,电子数越多,则半径越大.即同种元素:
阳离子半径<原子半径<阴离子半径 如:H+<H<H-; Fe>Fe2+ >Fe3+ ;Na+<Na;Cl<Cl-
|
金属性强弱 |
非金属性强弱 |
|
最高价氧化物水化物碱性强弱 |
最高价氧化物水化物酸性强弱 |
|
与水或酸反应,置换出H2的易难 |
与H2化合的易难及生成氢化物稳定性 |
|
活泼金属能从盐溶液中置换出不活泼金属 |
活泼非金属单质能置换出较不活泼非金属单质 |
|
阳离子氧化性强的为不活泼金属,氧化性弱的为活泼金属 |
阴离子还原性强的为非金属性弱,还原性弱的为非金属性强 |
|
原电池中负极为活泼金属,正极为不活泼金属 |
将金属氧化成高价的为非金属性强的单质,氧化成低价的为非金属性弱的单质 |
|
电解时,在阴极先析出的为不活泼金属 |
电解时,在阳极先产生的为非金属性弱的单质 |
(1)违背反应客观事实
如:Fe2O3与氢碘酸:Fe2O3+6H+=2 Fe3++3H2O错因:忽视了Fe3+与I-发生氧化一还原反应
(2)违反质量守恒或电荷守恒定律及电子得失平衡
如:FeCl2溶液中通Cl2 :Fe2++Cl2=Fe3++2Cl- 错因:电子得失不相等,离子电荷不守恒
(3)混淆化学式(分子式)和离子书写形式
如:NaOH溶液中通入HI:OH-+HI=H2O+I-错因:HI误认为弱酸.
(4)反应条件或环境不分:
如:次氯酸钠中加浓HCl:ClO-+H++Cl-=OH-+Cl2↑错因:强酸制得强碱
(5)忽视一种物质中阴、阳离子配比.
如:H2SO4  溶液加入Ba(OH)2溶液:Ba2++OH-+H++SO42-=BaSO4↓+H2O
溶液加入Ba(OH)2溶液:Ba2++OH-+H++SO42-=BaSO4↓+H2O
正确:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
(6)“=”“ ”“↑”“↓”符号运用不当
如:Al3++3H2O=Al(OH)3↓+3H+注意:盐的水解一般是可逆的,Al(OH)3量少,故不能打“↓”
7.因络合反应或其它反应而不能大量共存
如:Fe3+与F-、CN-、SCN-等; H2PO4-与PO43-会生成HPO42-,故两者不共存.
6.若阴、阳离子能发生氧化一还原反应则不能大量共存.
如:Fe3+与I-、S2-;MnO4-(H+)与I-、Br-、Cl-、S2-、SO32-、Fe2+等;NO3-(H+)与上述阴离子;
S2-、SO32-、H+
5.若阴、阳离子发生双水解反应,则不能大量共存.
如:Al3+与HCO3-、CO32-、HS-、S2-、AlO2-、ClO-、SiO32-等
Fe3+与HCO3-、CO32-、AlO2-、ClO-、SiO32-、C6H5O-等;NH4+与AlO2-、SiO32-、ClO-、CO32-等
4.若阴、阳离子能相互结合生成难溶或微溶性的盐,则不能大量共存.
如:Ba2+、Ca2+与CO32-、SO32-、PO43-、SO42-等;Ag+与Cl-、Br-、I- 等;Ca2+与F-,C2O42- 等
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com