
6.既能酸反应,又能与碱反应
(1)单质:Al
(2)化合物:Al2O3、Al(OH)3、弱酸弱碱盐、弱酸的酸式盐、氨基酸。
5.强烈双水解
4.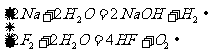 与水反应产生气体
与水反应产生气体
(1)单质

(2)化合物

3.Na2S2O3与酸反应既产生沉淀又产生气体: S2O32-+2H+=S↓+SO2↑+H2O
2. 与酸反应产生气体
与酸反应产生气体
(1)
(2)
1.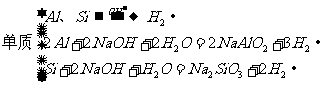 与碱反应产生气体
与碱反应产生气体
(1)
(2)铵盐:
3.对于有气体参与的可逆反应


一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组成成分的百分含量保持不变,这一状态称作化学平衡状态.

④若有1mol N≡N键断裂,则有6mol N-H键断裂(其它与上述相似)
注意 对象 词性
同种(侧)物质 相反
异侧物质 相同
2.百分含量不变标志
正因为v正=v逆≠0,所以同一瞬间同一物质的生成量等于消耗量.总的结果是混合体系中各组成成分的物质的量、质量、物质的量浓度、各成分的百分含量、转化率等不随时间变化而改变.
2.根据物质在同条件下的状态不同. 一般熔、沸点:固>液>气.
如果常温下即为气态或液态的物质,其晶体应属分子晶体(Hg除外).如惰性气体,虽然构成物质的微粒为原子,但应看作为单原子分子.因为相互间的作用为范德华力,而并非共价键.
1.由晶体结构来确定.首先分析物质所属的晶体类型,其次抓住决定同一类晶体熔、沸点高
低的决定因素.
① 一般规律:原子晶体>离子晶体>分子晶体 如:SiO2>NaCl>CO2(干冰)
② 同属原子晶体,一般键长越短,键能越大,共价键越牢固,晶体的熔、沸点越高.
如:金刚石>金刚砂>晶体硅
③ 同类型的离子晶体,离子电荷数越大,阴、阳离子核间距越小,则离子键越牢固,晶体的 熔、沸点一般越高. 如:MgO>NaCl
④ 分子组成和结构相似的分子晶体,一般分子量越大,分子间作用力越强,晶体熔、沸点越高.
如:F2<Cl2<Br2<I2
⑤ 金属晶体:金属原子的价电子数越多,原子半径越小,金属键越强,熔、沸点越高. 如:Na<Mg<Al
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com