
3. – What are you going to do tomorrow?
– I feel like _____ the Summer Palace. Would you like ____ with me?
A. to visit, to go B. visiting, to go
C. visiting, going D. to visit, going
2. ________you have tried it, you can’t imagine how pleasant it is.
A. Unless B. Because C. Although D. When
第一节:语法和词汇知识(共20小题,每小题1分,满分20分)
从下列四个选项中选出最佳选项.
1. – How are you doing? – _____________.
A. I finished it by hand. B. Not bad. I’ve just passed an exam.
C. I worked it out all by myself. D. I’m doing my math homework.
21.(12分)某天然碱(纯净物)可看成是由NaOH和CO2反应后的产物所组成。称取天然碱样品4份溶于水后,分别逐滴加入相同浓度的盐酸溶液30.0mL,产生CO2的体积(标准状况)如下表:
|
|
Ⅰ |
Ⅱ |
Ⅲ |
Ⅳ |
|
盐酸的体积V/mL |
30.0 |
30.0 |
30.0 |
30.0 |
|
样品质量W/g |
3.32 |
4.15 |
5.81 |
7.47 |
|
CO2的体积V/mL |
672 |
840 |
896 |
672 |
(1)根据第Ⅰ组数据推测,若用2.49g样品进行同样的实验,应产生的CO2在标准状况下为___
__________________mL。
(2)另取3.32g样品在300℃下加热使其完全分解(此温度Na2CO3不分解),产生CO2112mL(标准状况)和水0.45g,通过计算确定该天然碱的化学式为____________________________。
(3)由上表第Ⅳ组数据可以确定所用盐酸的浓度为___________________mol/L。
(4)依据上表所列的数据及天然碱的化学式,讨论并确定上述实验中CO2的体积V(mL)(标准状况)与样品质量W(g)之间的关系式。将结果填入下表:
|
W的取值范围 |
V的数值或表达式 |
|
|
|
|
|
|
|
|
|
20.(14分)A、B、C、D、G都是含有同一种短周期元素的化合物,E是氧化物,H是单质,D是常见的强酸,反应①、②、③是工业生产中的重要反应,根据下图转化关系(反应条件及部分产物已略去)填空:

(1)若A、B、C、D、G均含X元素,且A的一个分子中只含有10个电子,G是复合肥料,则反应①、②、③是工业生产___________________的基本原理,M的化学式是___________。反应④的离子方程式是____________________。
(2)若A、B、C、D、G均含Y元素,Y元素处于X的相邻周期、相邻族,A为黄色固体,G可作净水剂,则M元素在周期表中的位置是___________________。其中反应①的化学方程式是____________________;将2.5t含A85%的矿石(杂质不参加反应)煅烧时,A中的Y元素有5.0%损失而混入炉渣,计算可制得98%的D的质量为__________________t。
19.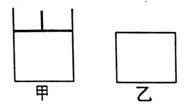 (12分)如图,有甲、乙两容器,甲体积可变压强不变,乙保持体积不变。向两容器中分别充入1molA、3molB,此时两容器体积均为500mL,温度为T℃。保持温度不变发生反应:
(12分)如图,有甲、乙两容器,甲体积可变压强不变,乙保持体积不变。向两容器中分别充入1molA、3molB,此时两容器体积均为500mL,温度为T℃。保持温度不变发生反应:

(1)下列选项中,能表明甲和乙容器中反应一定达到平衡状态
的是__________________________。
A.混合气体的总质量不随时间改变 B. 正(C)=
正(C)= 逆(B)
逆(B)
C.A、B转化率相等 D.物质D的质量不随时间改变
(2)2min后甲容器中的反应达到平衡,测得C的浓度为2mol/L,则B的转化率 (B)为
(B)为
____________________________________。
(3)乙容器中反应达到平衡所需要的时间_________2min(填“>”、“<”或“=”,下同),B的转化率 (B)_________
(B)_________ (B)
(B)
(4)其它条件不变,甲中如果从逆反应方向开始反应建立平衡,要求平衡时C的物质的量与上述(2)中平衡时C的物质的量相等,则需要加入C的物质的量n(C)为___________mol,加入D的物质的量n(D)的取值范围为__________________。
18. (12分)A、B、D、X、Y是由短周期元素组成的化合物,其中X是常见的强酸、Y是常见的强碱,它们的相互转化关系如右图(部分生成物和水略去)
(12分)A、B、D、X、Y是由短周期元素组成的化合物,其中X是常见的强酸、Y是常见的强碱,它们的相互转化关系如右图(部分生成物和水略去)
(1)若A、B均为气体,在水溶液中反应生成D,其中A具有漂白性,则A的化学式为______________,B发生催化氧化的化学方程式为__________________。
(2)若A、B、D含有相同的金属元素,工业用电解熔融氧化物的方法制取该金属单质。现将X滴入B的溶液中至过量,反应过程中的离子方程式依次为______________________________、
_____________________________________________。
(3)若A为非极性分子,灼烧B、D、Y时火焰均为黄色。则D+Y→B的离子方程式为_______
______________________________________________。
(4)现用右图装置电解某浓度Y的水溶液,则下列叙述中不正确的是(填序号)____________。
 ①电解过程中,阴极区溶液pH增大
①电解过程中,阴极区溶液pH增大
②电解一段时间后U型管内将有蓝色沉淀产生
③当电路中转移 时,阳极质量减少0.64g
时,阳极质量减少0.64g
④a口产生的是氢气,b口产生的是氧气
17.(12分)某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。

请回答下列问题:
(1)装置A中的烧瓶内固体不可以选用_________________(选填序号)。
A.生石灰 B.碱石灰 C.五氧化二磷 D.烧碱
(2)B装置的作用是_______________________;E装置的作用是_______________________。
(3)通入C装置的两根导管左边较长、右边较短,目的是_________________________。
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出C中反应的化学方程式:___________________________________________。
(5)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,如何处理?______________
____________________________________________________________________________。
16.今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、 、Mg2+、Ba2+、
、Mg2+、Ba2+、
 、
、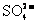 ,现取二等份溶液进行如下实验:(1)第一份加AgNO3溶液有沉淀产生;(2)第二份加足量NaOH溶液加热后,得澄清溶液,并收集到气体0.03mol。上述澄清溶液冷却后,加足量BaC12溶液,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是( )
,现取二等份溶液进行如下实验:(1)第一份加AgNO3溶液有沉淀产生;(2)第二份加足量NaOH溶液加热后,得澄清溶液,并收集到气体0.03mol。上述澄清溶液冷却后,加足量BaC12溶液,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是( )
①一定存在K+ ②一定存在Ba2+ ③可能存在 ④一定存在Mg2+
④一定存在Mg2+
⑤一定不存在 ⑥每份溶液中含0.01 mol
⑥每份溶液中含0.01 mol 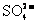
A.①②⑤ B.③④⑤ C.②④⑥ D.①③⑥
第Ⅱ卷 (非选择题,共62分)
15.某密闭容器中进行如下反应: ,若要使平衡时反应物总物质的量与生成物的总物质的量相等,且用X、Y作反应物,则X、Y的初始物质的量之比的范围应满足( )
,若要使平衡时反应物总物质的量与生成物的总物质的量相等,且用X、Y作反应物,则X、Y的初始物质的量之比的范围应满足( )
A. B.
B.
 C.
C.
 D.
D.

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com