
19. 一理想变压器原、副线圈匝数比n1 : n2=5
: 3。原线圈两端接一正弦式交变电流,其电压u随时间t变化的规律如图所示。当副线圈仅接入一个100
一理想变压器原、副线圈匝数比n1 : n2=5
: 3。原线圈两端接一正弦式交变电流,其电压u随时间t变化的规律如图所示。当副线圈仅接入一个100 的纯电阻用电器时,用电器恰能正常工作。则
的纯电阻用电器时,用电器恰能正常工作。则
A.变压器的输入功率是36W
B.该用电器的额定电压为60 V
V
C.该用电器的额定电压为100V
D.原线圈中的电流是0.60A
18.美国物理学家劳伦斯于1932年发明的回旋加速器,应用带电粒子在磁场中做圆周运动的特点,能使粒子在较小的空间范围内经过电场的多次加速获得较大的能量,使人类在获得较高能量带电粒子方面前进了一步。下图为一种改进后的回旋加速器示意图,其中盒缝间的加速电场场强大小恒定,且被限制在 、
、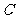 板间,如图所示。带电粒子从
板间,如图所示。带电粒子从 处以速度
处以速度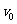 沿电场线方向射入加速电场,经加速后再进入
沿电场线方向射入加速电场,经加速后再进入 型盒中的匀强磁场做匀速圆周运动。对于这种改进后的回旋加速器,下列说法正确的是
型盒中的匀强磁场做匀速圆周运动。对于这种改进后的回旋加速器,下列说法正确的是
A.带电粒子每运动一周被加速两次
B.带电粒子每运动一周
C. 加速粒子的最大速度与D形盒的尺寸有关
D. 加速电场方向需要做周期性的变化
17. 我国在近两年将发射10颗左右的导航卫星,预计在2015年建成由30多颗卫星组成的“北斗二号”卫星导航定位系统,此系统由中轨道、高轨道和同步轨道卫星等组成.现在正在服役的“北斗一号”卫星定位系统的三颗卫星都定位在距地面36000km的地球同步轨道上。而美国的全球卫星定位系统(简称GPS)由24颗卫星组成,这些卫星距地面的高度均为20000km。则下列说法中正确的是
A. “北斗一号”系统中的三颗卫星的质量必须相等
B. GPS的卫星比“北斗一号”的卫星周期短
C. “北斗二号”中的每颗卫星一定比“北斗一号”中的每颗卫星的加速度大
 D. “北斗二号”中的中轨道卫星的线速度大于高轨道卫星的线速度
D. “北斗二号”中的中轨道卫星的线速度大于高轨道卫星的线速度
16.2009年11月15日上午10时,庆祝中国空军成立60周年飞行跳伞表演在首都京郊沙河机场拉开帷幕,空军八一跳伞队在北京沙河机场举行了首场表演,某跳伞队员从静止的直升机上跳下,先做自由落体运动,在t1时刻,速度达到v1时打开降落伞,做减速运动,在t2时刻以速度v2着地。他的速度图象如图所示。下列有关该跳伞队员运动过程的分析正确的是 ( )
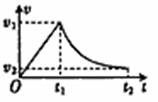 A.在t1~t2的时间内,其平均速度
A.在t1~t2的时间内,其平均速度
B.降落伞打开后降落伞和跳伞队员所受的阻力越来越小
C.若第一个跳伞队员跳下后,经过时间t1,第二个跳伞
队员跳下,则他们在空中的距离越来越大
D.若第一个跳伞队员跳下后,经过时间t1,第二个跳伞队员跳下,则他们在空中的距离越来越小
15.正电子发射型计算机断层显像(PET)的基本原理是:将放射性同位素 O注入人体,
O注入人体, O在人体内衰变放出的正电子与人体内的负电子相遇湮灭转化为一对
O在人体内衰变放出的正电子与人体内的负电子相遇湮灭转化为一对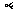 光子,被探测器采集后,经计算机处理生成清晰图象.则根据PET原理判断下列表述不正确的是
光子,被探测器采集后,经计算机处理生成清晰图象.则根据PET原理判断下列表述不正确的是
A. O在人体内衰变方程是
O在人体内衰变方程是 O→
O→ N+
N+ e
e
B.正、负电子湮灭方程是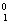 e +
e + e→2
e→2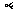
C.在PET中, O主要用途是作为示踪原子
O主要用途是作为示踪原子
D.在PET中, O主要用途是参与人体的新陈代谢
O主要用途是参与人体的新陈代谢
14. 华裔科学家高锟获得2009年诺贝尔物理奖,他被誉为“光纤通讯之父”。
光纤通讯中信号传播的主要载体是光导纤维,它的结构如图所示,其内芯和外套材料不同,光在内芯中传播。下列关于光导纤维的说法中正确的是
华裔科学家高锟获得2009年诺贝尔物理奖,他被誉为“光纤通讯之父”。
光纤通讯中信号传播的主要载体是光导纤维,它的结构如图所示,其内芯和外套材料不同,光在内芯中传播。下列关于光导纤维的说法中正确的是
A.内芯的折射率比外套的大,光传播时在内芯与外套的界面上发生全反射
B.内芯的折射率比外套的小,光传播时在内芯与外套的界面上发生全反射
C.波长越短的光在光纤中传播的速度越大
D.频率越大的光在光纤中传播的速度越大
30.(16分)下图中A、B、C、D、E、F、G、H均为有机化合物。

回答下列问题:
(1)链状有机化合物A的相对分子质量介于60到70间,A能发生银镜反应,1molA在催化剂作用下能与3 mol H2反应生成B,则A的结构简式是_______________________ ;
(2)B在浓硫酸中加热可生成C,C在催化剂作用下可聚合生成高分子化合物D,由C生成D的化学方程式是________________________________________________________;
(3)①芳香化合物E的分子式是C8H8Cl2。E的苯环上的一溴取代物只有一种,则E的所有可能的结构简式共有______________种 ;
②E在NaOH溶液中可转变为F,F用酸性高锰酸钾溶液氧化生成G(C8H6O4)。1 mol G与足量的 NaHCO3溶液反应可放出 44.8 L CO2(标准状况),由此确定E的结构简式是______________________ ;G的名称是_______________________________________ ;
(4)1 mol G 和足量的B在浓硫酸催化下加热反应可生成H,则由G和B生成H的化学方程式是_____________________________________________________________________,该反应的反应类型是______________________。
29. (12分)I.在温度为500K,2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:
(12分)I.在温度为500K,2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:
(1)反应的化学方程式为 ;
(2)反应开始到10s,用X表示的该段时间的反应速率为 ;(保留3位有效数字)
(3)达平衡后再升高温度,测知X的转化率增大,则该反应的ΔH
0(填“<”、“>”或“=” )
II.如果在相同的温度(500K)和固定的压强下进行上述反应:
(1)若开始时放入3.60 molX和3.00 mol Y,达平衡后,生成Z的物质的量是 mol;
(2)若开始时放入a molX,b mol Y和1.00 molZ,到达平衡后, Z的物质的量分数
与(1)中Z的物质的量分数相同,则a、b应满足的关系是 ;
若b = 1.50 mol,则a = mol.
28. (16分)纯碱、烧碱等是重要的化工原料。
⑴利用如图所示装置可间接证明二氧化碳与烧碱溶液发生了反应。将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是 ;
若其它操作不变,将A与C连接,可观察到的现象是 。
⑵向100mL 2mol/L的NaOH溶液中通入一定量CO2,低温结晶,得到9.3g白色固体,该白色因体的组成是 (写化学式)。请你设计实验确定该白色固体存在的阴离子,试完成下列方案:
|
实验操作 |
实验现象 |
结论 |
|
①取少量白色固体于试管中,加适量水溶解,再加足量BaC12溶液 |
|
|
|
②过滤,取2mL滤液于试管中 |
 |
 |
|
③ |
|
|
27.(16分) X、Y、Z、Q、R五种元素原子序数依次增大,且X和Y,Z和Q分别同周期,Q、R同主族且相邻,X的低价氧化物与Y单质分子的电子总数相等,Z和Q的核电荷数相差4,Q的2价简单离子与Ar原子的电子层结构相同。根据以上信息填空:
(1)Q离子的结构示意图______________;R的元素符号为___________;
(2)Y的气态氢化物空间构型是_______________;X和Q形成的共价化合物的电子式是_________________,属于__________分子(填“极性”或“非极性”);
(3)Y的最高价氧化物对应的水化物的稀溶液与Z的单质反应时,Y被还原到最低价,该反应的化学方程式是 ;
 (5)核电荷数比Q多1的元素T,在298K时,T的最高价氧化物为无色液体,0.25
mol该物质与一定量水混合得到T的最高价氧化物的水化物的稀溶液,并放出a kJ的热量。该反应的热化学方程式为 。
(5)核电荷数比Q多1的元素T,在298K时,T的最高价氧化物为无色液体,0.25
mol该物质与一定量水混合得到T的最高价氧化物的水化物的稀溶液,并放出a kJ的热量。该反应的热化学方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com