
3.下列叙述正确的是
A.当病毒侵入人体后,只有细胞免疫发挥防御作用
B.大肠杆菌在葡萄糖和乳糖为碳源的培养基上,只有葡萄糖耗尽时才能利用乳糖
C.在水分供应充足的大田中,只有通风透光才能提高光能利用率
D.当甲状腺激素含量偏高时,只有反馈抑制下丘脑活动才能使激素含量恢复正常
2.下列结构和物质,可以成为人体第一、二道防线,参与人体非特异性免疫的是
①骨髓 ②扁桃体 ③淋巴细胞 ④抗体 ⑤皮肤、粘膜 ⑥吞噬细胞 ⑦杀菌物质
A.①③④⑤⑥ B.③④⑥
C.①②③④⑥ D.⑤⑥⑦
1.下列关于玉米叶片结构及其光合作用过程的叙述正确的是
①围绕维管束的叶肉细胞呈“花环型”,且排列紧密;②水的光解在叶绿体的基粒上进行;③CO2中的C首先转移到C4 化合物中;④光能转化为电能时,电子的最终受体是ATP和NADP+;⑤NADPH既是还原剂,又是活跃的化学能源物质之一。
A.①②③ B.②④⑤ C. ①③④ D.①②③⑤
16、标准状况下,11.2L氦气含有的原子数为 个。(×)
个。(×)
分析15时应考虑盐酸在溶液中已完全电离为 和
和 ,所以,不存在
,所以,不存在 分子;16则有一些同学草率地将氦气(惰性气体,为单原子分子)和常见的
分子;16则有一些同学草率地将氦气(惰性气体,为单原子分子)和常见的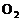 、
、 等气体一样当作双原子分子而判断失误。
等气体一样当作双原子分子而判断失误。
从上述分析可见,有关阿伏加德罗常数的问题由于可以和许多其它化学知识联系起来而极富变化,常考常新,学生必须在平常的学习中打好坚实的基础,才能以不变应万变,决不能寄希望于“题海”,否则,如同大海捞针,终无所获。
除上述几种情况以外,有关阿伏加德罗常数的问题还有别的一些变换,稀有气体中的原子数和分子数相等如:
15、1L2mol/L的盐酸中含有2 个HCl分子。(×)
个HCl分子。(×)
12、13、14都是在变价金属与氧化剂反应时被氧化的价态上进行考查,因为铜或铁与弱氧化剂硫粉、单质碘反应时,往往只被氧化为低价( 、
、 ),每个原子反应时仅失去1个或2个电子,而它们与氯气、单质溴等反应时,却被氧化为高价(
),每个原子反应时仅失去1个或2个电子,而它们与氯气、单质溴等反应时,却被氧化为高价( 、
、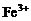 ),每个原子反应时失去2个或3个电子。所以,必须认真审题,具体情况具体分析。14中“铁和酸反应”未指明酸是强氧化性的硝酸等还是一般的酸如盐酸,因为这两种情况下,不仅生成的气体不同(前者可能是NO或
),每个原子反应时失去2个或3个电子。所以,必须认真审题,具体情况具体分析。14中“铁和酸反应”未指明酸是强氧化性的硝酸等还是一般的酸如盐酸,因为这两种情况下,不仅生成的气体不同(前者可能是NO或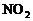 ,后者是
,后者是 ),而且Fe被氧化的价态也不同(前者可能生成
),而且Fe被氧化的价态也不同(前者可能生成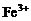 ,而后者生成
,而后者生成 ),因而放出标准状况下2.24L气体时,转移的电子数不同,不一定为2
),因而放出标准状况下2.24L气体时,转移的电子数不同,不一定为2 。
。
14.铁和酸反应,放出标准状况下2.24L气体时,转移的电子数必为2 。(×)
。(×)
13.5.6g铁粉与足量硫粉(氯气、液溴、碘)反应,失去3 个电子。(×/√/√/×)
个电子。(×/√/√/×)
涉及氧化还原反应时,还经常对电子转移数目进行判断,如:
12.6.4g铜与足量硫粉(氯气、液溴)反应,转移的电子数为0.2 。(×/√/√)
。(×/√/√)
11、1.4g亚甲基( )含有的电子数为0.8
)含有的电子数为0.8 个。(√)
个。(√)
在9中,8g 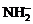 的物质的量为0.5mol,而1个
的物质的量为0.5mol,而1个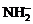 含有的电子数为10个,所以其含有的电子数为5
含有的电子数为10个,所以其含有的电子数为5 。但许多同学由于没有注意到
。但许多同学由于没有注意到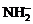 的-1价,认为1个
的-1价,认为1个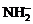 含有的电子数为9个而致错。类似地,判断10、11时也应特别注意此类变换。
含有的电子数为9个而致错。类似地,判断10、11时也应特别注意此类变换。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com