
69.下图各物质间的反应均在溶液中进行,已知甲、乙为化合物,丙为单质。根据图示关系回答:

(1)CuCl2与物质丙反应的基本类型是___________;
(2)请你推出物质X的化学式___________,物质甲的名称可能是___________;
(3)写一个有X生成的复分解反应的化学方程式:___________________
68.某化工厂的废液中,可能含有H2SO4、K2CO3、Na2SO4、KCl、NaNO3、FeCl3、HNO3七种物质中的两种。进行有关实验,所观察到的现象记录如下表。试根据各步实验及其现象先进行分步推断,再推断所取的废液的可能组合。
|
步骤 |
实验操作 |
实验现象 |
推断(或结论) |
|
(1) |
取废液放入试管观察 |
废液无色、澄清 |
废液中肯定不含:FeCl3 |
|
(2) |
用pH广泛试纸测定废液的pH |
测定结果:pH=3 |
|
|
(3) |
向废液中滴入足量Ba(NO3)2溶液 |
有白色沉淀出现 |
|
|
(4) |
向上述过滤所得的滤液中滴加AgNO3溶液 |
无明显反应现象 |
|
|
废液成分的可能组合(写出溶质的化学式) |
①________________________________ ②________________________________ ③________________________________ |
67.兴华化工厂排出的废水使村旁小河里的鱼虾频频死亡。李文同学通过实验证明该废水中含有硫酸铜。
(1)请你帮他完成实验报告
|
实验步骤 |
实验现象 |
结论 |
|
①取2mL废水加入试管中, 滴入适量氢氧化钠溶液 |
|
|
|
②取2mL废水加入另一试管中,滴入适量硝酸钡溶液 |
|
|
(2)甲、乙、丙三位同学分别提出下列三种治理这种废水的方案:
甲:加适量烧碱沉淀后排放乙;加适量生石灰沉淀后排放丙:加适量氯化钙沉淀后排放
上述化工产品的市场参考价格:烧碱15元/kg生石灰0.3元/kg氯化钙4元/kg
经分析比较、综合考虑后,你认为________同学提出的方案最合理,理由是_________。
66.硫酸亚铁是一种重要的化工原料,用途十分广泛。如医疗上可用于治疗缺铁性贫血;农业中可施用于缺铁性土壤等。某校化学兴趣小组,利用工业废铁屑为原料,设计如下两种制备硫酸亚铁的方案:
①Fe+H2SO4 FeSO4+H2↑②2FeO+4H2SO4(浓)
FeSO4+H2↑②2FeO+4H2SO4(浓) Fe2(SO4)3+SO2↑+4H2O
Fe2(SO4)3+SO2↑+4H2O
Fe+Fe2(SO4)3 3FeSO4
3FeSO4
(1)两种方案都有一定的理论依据,他们选用了方案①,那么不用方案②的理由是____________________;
(2)工业废铁屑常沾有油污,去除油污的方法是________________________________;
(3)他们在配制所需的稀硫酸时使用了自来水,小明提出自来水中含有少量的Cl-,会影响到制出的FeSO4的纯度。请你设计实验证明已配制的稀硫酸中混有Cl-;
|
实验步骤 |
实验现象 |
结论 |
|
|
|
|
|
|
|
|
(4)实验过程中,如何判断方案①的反应已停止_________;
(5)利用工业废铁屑为原料制备硫酸亚铁的现实意义是_________。
65.A、B、C、D四种化合物,在日常家庭生活中都得到广泛应用。其中A、B通常情况下为液体,C、D为固体。A是生命之源,人们每天都必须饮用它;B是一种调味品的主要成分,用该调味品可除去水壶中的水垢;C常用作干果的干燥剂;把D加入经发酵后的面团中,使蒸出的馒头松软可口。回答下列问题:
(1)这种调味品是__________,C的俗称是__________。
(2)把适量的A滴在一小块C上,产生大量的A蒸气,其原因是_____________________。
(3)写出A与C反应的产物的溶液跟D的溶液反应的化学方程式:______________;该反应类型是__________。
64.某学生为了测定实验室中一瓶因保存不善而部分变质的氢氧化钠中碳酸钠的质量分数,设计了如下图所示的装置(图中铁架台已略去),实验在27℃,101kPa下进行,实验步骤如下:

①按图连接好装置;②用天平准确称取氢氧化钠样品2g,放入A中试管内,向B中集气瓶内倒入饱和二氧化碳水溶液至瓶颈处;③向分液漏斗中倒入稀硫酸,打开活塞,让稀硫酸滴入试管中至过量,关闭活塞。反应结束后,量筒中收集到饱和二氧化碳水溶液220mL。请回答下列问题:
(1)判断氢氧化钠发生变质的实验现象是______________________;氢氧化钠变质的原因是______________________________;因此,实验室中氢氧化钠必须__________保存。
(2)在实验步骤①和②之间,还缺少-实验步骤,该实验步骤是______________________________。
(3)B中集气瓶盛装的饱和二氧化碳水溶液不能用水代替,其理由是______________________________。
(4)判断实验步骤③中滴入的稀硫酸已过量的标志是___________________________
(5)氢氧化钠样品中碳酸钠的质量分数为__________。(在27℃,101kPa时二氧化碳的密度为1.8g/L;二氧化碳的体积等于排出的饱和二氧化碳水溶液的体积。)
(6)用上述装置不能测定已部分变质的氢氧化钠样品中氢氧化钠的质量分数,理由是__________________________________________________。
63.如果以碳酸钙、碳酸钠、水为原料制取氢氧化钠,可设计如下反应过程:
碳酸钙 氧化钙
氧化钙 氢氧化钙
氢氧化钙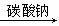 氢氧化钠
氢氧化钠
如果以锌、稀硫酸和氧化铜为原料制取单质铜,可有两种设计方案,请你按照上面的设计格式,完成以下设计方案。
方案一:Zn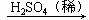
方案二:CuO
在以上两个设计方案中,你认为方案________操作更合理、更简便。
62.向某盐溶液中,加入氢氧化钠溶液时,有红褐色沉淀生成;若加入硝酸钡溶液时,有不溶于稀硝酸的白色沉淀生成,则该盐的化学式为___________。写出上述红褐色沉淀与盐酸反应的化学方程式___________。
60.现有甲、乙两种溶液,共含有8种离子,分别为H+、Ag+、K+、Ba2+、OH-、Cl-、NO3-和CO32-,且两种溶液里所含的离子各不相同。已知向甲溶液里滴入紫色石蕊试液,溶液变成蓝色,说明甲溶液呈________(填“酸性”、“碱性”或“中性”),那么乙溶液里含有的4种离于是(填离子符号)________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com