
3.已知平面向量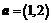 ,
,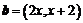 ,若
,若 ,则实数
,则实数 =
▲ .
=
▲ .
2. (建议出常用逻辑用语部分题目,难度系数0.85)
1. (建议出集合运算部分题目,难度系数0.9)
28.(14分)面对全球近期的气候异常,环境问题再次成为焦点。SO2 、NOx、CO2 是对环境影响较大的气体,对他们的合理控制和治理是优化我们生存环境的有效途径。
(1)下列措施中,有利于降低大气中的SO2、NOx、CO2 浓度的有 (选填字母)。
a.减少化石燃料的使用,加快开发和利用风能、氢能等新能源
b.使用无磷洗涤用品,减少含磷废物的排放
c.多步行或乘公交车,少用专车或私家车
d.在屋顶安装太阳能热水器为居民提供生活用热水
(2)用甲醇替代作为汽车燃料可降低汽车尾气污染。已知用合成气(CO和H2)合成1
mol液态甲醇吸收热量为131.9 kJ,2H2 (g) + CO(g) + O2 (g)
= CO2(g) +2H2O (g) △H
=
O2 (g)
= CO2(g) +2H2O (g) △H
=
-594.1 kJ/mol,请写出液态甲醇燃烧生成二氧化碳和水蒸气的热化学方程式 。
 (3)现欲以右图所示装置用电化学原理将CO2、SO2 转化为重要化工原料。
(3)现欲以右图所示装置用电化学原理将CO2、SO2 转化为重要化工原料。
①若A为CO2,B为H2,C为CH3OH,则通入H2 的一极
为 极;
②若A为SO2,B为O2,C为H2SO4,则负极的电极反应式为 。
(4)①已知:密闭容器中,17℃、1.01×105
Pa条件下,2NO2(g)  N2O4(g) △H <0的平衡常数K=13.3。
N2O4(g) △H <0的平衡常数K=13.3。
当此反应达到平衡时,若 c (NO2) = 0.030 mol/L,则 c (N2O4)= (保留两位有效数字);
②若改变上述体系的某个条件,达到新的平衡后,测得混合气体中 c (NO2) = 0.04 mol/L,c (N2O4) = 0.007 mol/L,则改变的条件是 。
崇文区2009-2010学年度第二学期高三统一练习(二)
27.(12分)硫酸铜、硝酸铁都是重要的化工原料。
(1)以下是某工厂用含铁的废铜为原料生产胆矾(CuSO4·5H2O)的生产流程示意图:

胆矾和石膏在不同温度下的溶解度(g/100g水)见下表。
|
温度(℃) |
20 |
40 |
60 |
80 |
100 |
|
石膏 |
0.32 |
0.26 |
0.15 |
0.11 |
0.07 |
|
胆矾 |
32 |
44.6 |
61.8 |
83.8 |
114 |
请回答下列问题:
①红褐色滤渣的主要成分是__________;
②写出浸出过程中生成硫酸铜的化学方程式 ;
③操作I的温度应该控制在________左右;
④从溶液中分离出硫酸铜晶体的操作II应为将热溶液_______、______、洗涤、干燥。
(2)某兴趣小组在实验室用铁粉和稀硝酸及右图装置制取Fe(NO3)3
(固定所用仪器和加热装置未画出)。
 ①为保证原料的充分利用并加快反应速率,往往将温度控制在 100℃以内。该实验中对圆底烧瓶加热的最佳方式是 加热;
①为保证原料的充分利用并加快反应速率,往往将温度控制在 100℃以内。该实验中对圆底烧瓶加热的最佳方式是 加热;
②请在图中虚线框内画出尾气吸收装置
(提示:碱液可快速、充分吸收产生的氮氧化物气体)。
26. (12分) X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3∶4。请回答:
(12分) X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3∶4。请回答:
(1)X的电子式 ;若实验室用如图所示装置制取X,
则制取X的化学反应方程式为 。
 (2)已知: W + X + H2O
→ 白色沉淀,为进一步确定W,进行如下实验,请补全实验操作、现象和结论:取上述白色沉淀少量置于试管中, 。
(2)已知: W + X + H2O
→ 白色沉淀,为进一步确定W,进行如下实验,请补全实验操作、现象和结论:取上述白色沉淀少量置于试管中, 。
(3)常温下,取10 mL pH= a的Y的稀溶液,加水稀释时pH随溶液体积的变化如图所示,则Y的化学式为 ,下列叙述正确的是 (选填字母)。
a.Y的水溶液可用作刻蚀玻璃
b.相同温度时与相同浓度的盐酸比较,Y的水溶液的导电
能力弱
c.稀释后,阴离子的物质的量浓度之和增大
(4)Z分子中所含某元素对应的单质A及A与B形成的化合物可进行如下转化:

当n=1时,请写出A→ABn的化学方程式____________(写出一个即可)。
25.(20分) 某芳香族化合物A的分子中含有C、H、O、N四种元素,相同状况下,其蒸气的密度为氢气密度的68.5倍。现以苯为原料合成A,并最终制得F(一种染料中间体),转化关系如下:(一些非主要产物已略去)
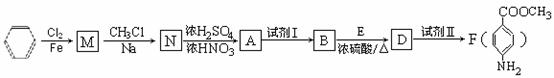
已知:

请回答下列问题:
(1)写出A的分子式 ;A的结构简式 。
(2)N→A的反应类型是 。
(3)①上述转化中试剂Ⅰ和试剂Ⅱ分别是:试剂Ⅰ ;试剂Ⅱ (选填字母)。
a. KMnO4(H+) b. Fe/盐酸 c. NaOH溶液
②若上述转化中物质A依次与试剂Ⅱ、试剂Ⅰ、化合物E(浓硫酸/△)作用,能否得到F,为什么? 。
(4)用核磁共振氢谱可以证明化合物E中含有 种处于不同化学环境的氢。
(5)写出同时符合下列要求的两种D的同分异构体的结构简式 。
①属于芳香族化合物,分子中有两个互为对位的取代基,其中一个取代基是硝基;
②分子中含有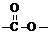 结构。
结构。
(6)有一种D的同分异构体W,在酸性条件下水解后,可得到的一种能与FeCl3溶液发生显色反应的产物,写出W在酸性条件下水解的化学方程式 。
(7)F的水解反应如下:

化合物H在一定条件下经缩聚反应可制得高分子纤维,广泛用于通讯、导弹、宇航等领域。
请写出该缩聚反应的化学方程式 。
12.常温时,下列溶液的pH或微粒的物质的量浓度关系不正确的是
A.某物质的溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,则该溶液的pH一定为14-a
B.某溶液中存在的离子有Cl-、OH-、NH4+、H+,则离子浓度不一定是
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C.pH=3的二元弱酸H2R溶液与 pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:2c(R2-)+ c(HR-)=c(Na+)
D.将0.2 mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:2c(OH-)+ c(A-)=2c(H+)+c(HA)
第Ⅱ卷(非选择题 共180分)
本卷共11小题,共180分。
11.
 用铅蓄电池(总反应:Pb+PbO2+4H++2SO42- 2PbSO4+2H2O)电解苦卤水 (含C1―、Br―、Na+、Mg2+)的装置如图所示 (a、b为石墨电极)。
用铅蓄电池(总反应:Pb+PbO2+4H++2SO42- 2PbSO4+2H2O)电解苦卤水 (含C1―、Br―、Na+、Mg2+)的装置如图所示 (a、b为石墨电极)。
下列说法中正确的是
A.铅蓄电池放电时的正极反应是:
PbO2+4H++SO42- =PbSO4+2H2O
B.电解苦卤水时,a 电极首先放电的是Br―而不是Cl―,
说明当其它条件相同时Br―的还原性强于Cl―
C.铅蓄电池充电时,A极应与外接电源负极相连
D.忽略能量消耗,当b极产生0.02g气体时,铅蓄电池中消耗0.01 mol H2SO4
10.下列说法不正确的是
A.在一定条件下,催化分解80g SO3,混合气体中氧原子数为3×6.02×1023
B.一定条件下,铁与水蒸气反应生成8.96L H2时(已折合成标况),转移的电子数为0.8×6.02×1023
C.各100mL 1mol/L AlCl3与3mol/L NaCl溶液混合后,Cl-的个数为0.6×6.02×1023
D.含有非极性键的数目为6.02×1023的Na2O2与水充分反应产生标况下22.4L O2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com