
4.(16分)难溶物在水中溶解达到饱和时,即建立沉淀溶解平衡,平衡常数称为溶度积(Ksp)。已知25℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=2.5×10-9。
1)将浓度均为0.1 mol·L-1的BaCl2溶液与Na2SO4溶液等体积混合,充分搅拌后过滤,滤液中c (Ba2+) =____mol·L-1。
2)医学上进行消化系统的X射线透视时,常使用BaSO4作内服造影剂,这种透视俗称钡餐透视。请用沉淀溶解平衡原理解释以下问题:
①胃酸很强(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是_____________。
②BaCO3不能代替BaSO4作为“钡餐”的原因____________________________________________________。
 (3)万一误服了少量BaCO3,应尽快用大量0.5 mol·L-1Na2SO4溶液给患者洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为_____________mol·L-1。
(3)万一误服了少量BaCO3,应尽快用大量0.5 mol·L-1Na2SO4溶液给患者洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为_____________mol·L-1。
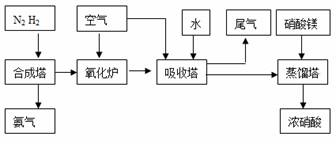
3.(16分)工业上制备BaCl2的工艺过程如下:(1)重晶石矿中加入过量的炭,高温焙烧;(2)加入盐酸溶解,产生的气体用过量NaOH溶液吸收;(3)过滤,结晶,得到BaCl2
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s) + 4C(s) 4CO(g) + BaS(s)
△H1 =571.2 kJ·mol-1 ①
4CO(g) + BaS(s)
△H1 =571.2 kJ·mol-1 ①
BaSO4(s) + 2C(s) 2CO2(g) + BaS(s) △H2=226.2 kJ·mol-1 ②
2CO2(g) + BaS(s) △H2=226.2 kJ·mol-1 ②
1)反应C(s) + CO2(g) 2CO(g),△H =_____________ kJ·mol-1。
2CO(g),△H =_____________ kJ·mol-1。
2)产生的气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为__________________。
3)实际生产中重晶石矿中必须加入过量的炭,同时还要通入空气,其目的是
Ⅰ__________________________________; Ⅱ___________________________________。
2.(越秀区一模)Ⅰ一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g) 4NO2(g)+O2(g)
△H>0,下表为反应在T1℃下的部分实验数据:
4NO2(g)+O2(g)
△H>0,下表为反应在T1℃下的部分实验数据:
 (1)在T1℃,反应500s内N2O5的分解速率为
。
(1)在T1℃,反应500s内N2O5的分解速率为
。
(2)其它条件不变,改变温度,在T2℃下,反应1000s时,测得c(NO2)为4.98 mol·L-1,则T2℃时c(N2O5)为_______,则T2___ T1(填“>”或“<”)。
(3)下图装置可用于制备N2O5,则N2O5在电解池的_______区生成,其电极反应式为 _____________。
 Ⅱ(16分)已知一氧化碳与水蒸气的反应为:CO(g)+H2O
(g)
Ⅱ(16分)已知一氧化碳与水蒸气的反应为:CO(g)+H2O
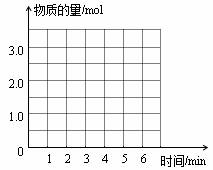
(g) CO2(g)+H2(g) ,800℃时,在容积为2.0L的密闭容器中充入2.0mol CO(g)和3.0mol H2O(g),保持温度不变,4 min后反应达到平衡,测得CO的转化率为60%。
CO2(g)+H2(g) ,800℃时,在容积为2.0L的密闭容器中充入2.0mol CO(g)和3.0mol H2O(g),保持温度不变,4 min后反应达到平衡,测得CO的转化率为60%。
(1)平衡时H2O的物质的量为_____________mol。
(2)计算800℃时该反应的平衡常数。(写计算过程)
(3)427℃时该反应的化学平衡常数为9.4,请结合(2)中的计算结果判断该反应的ΔH ______0(填“>”“<”或“=” )。
(4)请在坐标图中,画出上述反应过程H2O的物质的量随时间变化的图像(用实线)。假定反应温度高于800℃(其它条件均不变),在坐标图中再次画出H2O的物质的量随时间变化的示意图(用虚线)。
假定反应温度高于800℃(其它条件均不变),在坐标图中再次画出H2O的物质的量随时间变化的示意图(用虚线)。分析上图能够得出的实验结论是 。
1.(汕头澄海)运用化学反应原理研究氮的单质及其化合物的反应有重要意义。
⑴ 联氨(N2H4)及其衍生物是一类重要的火箭燃料。N2H4与N2O4反应能放出大量的热。
① 已知:2NO2(g) N2O4(g) △H = -57.20 kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g) N2O4(g)达到平衡。其他条件不变时,下列措施能提高NO2转化率的是
(填字母)。(BC)
N2O4(g) △H = -57.20 kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g) N2O4(g)达到平衡。其他条件不变时,下列措施能提高NO2转化率的是
(填字母)。(BC)
A. 减小NO2的浓度 B. 降低温度 C. 增加NO2的浓度 D. 升高温度
|
时间 / s |
0 |
80 |
160 |
240 |
320 |
|
c(NO2)/ mol·L-1 |
0.0540 |
0.0420 |
0.0340 |
0.0300 |
0.0300 |
|
c(N2O4)/ mol·L-1 |
0 |
0.0060 |
0.0100 |
0.0120 |
0.0120 |
② 下表为反应2NO2(g N2O4(g)在17 ℃、1.01×105 Pa下的部分实验数据:该温度下反应N2O4(g)
N2O4(g)在17 ℃、1.01×105 Pa下的部分实验数据:该温度下反应N2O4(g) 2NO2(g)的平衡常数K的值为 。
2NO2(g)的平衡常数K的值为 。
③ 25℃时,1.00 gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量。则反应2N2H4(l)+ N2O4(l)= 3N2(g)+ 4H2O(l)的△H = kJ·mol-1。
⑵ Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。该电池的负极材料是 。电池工作时,电子流向 (填“正极”或“负极”)。
⑶ 在25 ℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液的pH = 7,则溶液中c(NH4+)与 c(Cl-)的大小关系为:c(NH4+) c(Cl-)(填“>”、“<”或“=”)。
|
t/s |
0 |
500 |
1000 |
|
c(N2O5)/mol·L-1 |
5.00 |
3.52 |
2.48 |
21.共青团中央、全国学联等机构共同发布的《2009年中国大学生消费与生活形态研究报告》表明,当代大学生群体正呈现出以下两个特性。(4分)
①__________________________________。大学生作为无固定收入的群体,无论是必要的学费和生活费,还是休闲娱乐消费,在很大程度上都依赖于家庭的经济支持;但他们又具有明显的独立意识与倾向,他们并不认为花父母的钱天经地义,大多数学生都在自筹收入。
②__________________________________。大学生追求个性释放,希望自己成为有独特风格的人,也喜欢风格独特的产品与品牌。但是这种独特是群体的独特,作为相互接触的群体,他们具有高度一致性;同时作为群体中的个体,他们希望并主动与群体保持一致,并以这种一致获得群体的认同。
根据以上表述,在下面的横线处概括这两个特性。(每处不超过10个字)
①____________________________________________
②____________________________________________
20.提取下列材料的要点,整合成一个单句,为“低碳经济”下定义。(5分)
(1)低碳经济是一种新型的社会经济发展模式。
(2)低能耗、低排放是低碳经济所具有的基本经济特征。
(3)能源的清洁开发与高效利用是实行低碳经济的基础。
(4)这是可持续发展理念所提出的要求。
答:低碳经济是____________________________________________________________________
__________________________________________________________________________________
15、文学常识与名句填空。(5题选4题,每空1分,共8分)
(1)我国古代小说发展到 时期达到顶峰,标志性作品为“古典四大名著”。
是魏晋以后产生的一种新文体,南北朝是其全盛时期。句式多以四、六字句为主,但常常夹有杂言,又称“四六文”。
(2)此去经年, 。 ,更与何人说!
(柳永《雨霖铃》)
(3)《离骚》中提及屈原生辰年月日的句子是: , 。
(4)王维《山居秋暝》中写农人生活的句子是: , 。
(5)余于仆碑, , ,何可胜道也哉!
(王安石《游褒禅山记》)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com