
6. actually adv. 实际上
5. fashionable adj 时髦的、时尚的
4. outdated adj 过时的
3. old - fashioned adj. 过时的、老式的
2. ashamed adj 惭愧的、害臊的
1. mobile adj 可移动的
19.(14分)肼(N2H4)又称联氨,是一种可燃性液体,与氧气或氮氧化物等反应均可生成氮气和水,可以用作火箭燃料。请回答下列问题: (1)写出肼与一氧化氮反应的化学方程式 。
(2)联氨溶于水显碱性,其原理与氨相似,但碱性不如氨水强,试写出其溶于水呈碱性 的离子方程式 。 (3)肼一空气燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的氢氧化钾溶液。该电池放电时,正极的电极反应式为 。 (4)如图是一个电化学装置示意图,用肼一空气燃料电池作此装置的电源。 ①若A为粗铜(Fe、Ag、CO杂质),B为纯铜,C为CuSO4溶液。
 通电一段时问后,溶液中Cu2+的浓度将
通电一段时问后,溶液中Cu2+的浓度将
(填“增大”“不变”“减小”) ②若A为铂电极,B是石墨电极,c为硫酸,
则阴极的电极反应式为 。 利用该装置可制得少量过氧化氢,在阳极上SO42-被氧化成S2O82-(过二硫酸根离子), S2O82-与水反应即可生成H2O2:S2O82-+2H20=2 SO42-十H2O2+2H+ 若要制取l moL H2O2,该燃料电池理论上需消耗 mol N2H4。 (5)火箭推进器中分别装有联氨和过氧化氢,它们发生反应时产生气体,并放出大量热。已知:12.8 g液态联氨与足量过氧化氢反应生成氮气和水蒸气,放出256.65 kJ的热量,另外还知: H2O(1)===H2O(g) △H=+44 kJ·mol-1 2H2O2(1)===2H2O(1)+O2(g) △H=-196.4 kJ·mol-1 写出联氨与氧气反应生成液态水的热化学方程式为 。
厦门外国语学校
18.(15分)合成氨工业的核心反应是:
 能量变化如右图,回答下列问题:
(1)在反应体系中加入催化剂,反应速率增大,E1和
E2的变化是:E1 ,E2
(填“增大”、“减小”、“不变”)
(2)在500℃、2×107Pa和催化剂条件下向一密闭容器中充入0.5mol N2和1.5mol H2,充分反应后,放出的热量
(填“<”、“>”或“=”)46.2kJ,理由是
能量变化如右图,回答下列问题:
(1)在反应体系中加入催化剂,反应速率增大,E1和
E2的变化是:E1 ,E2
(填“增大”、“减小”、“不变”)
(2)在500℃、2×107Pa和催化剂条件下向一密闭容器中充入0.5mol N2和1.5mol H2,充分反应后,放出的热量
(填“<”、“>”或“=”)46.2kJ,理由是
_____________________________________________________________________________________; (3)关于该反应的下列说法中,正确的是 。 A.△H>0,△S>0 B.△H>0,△S< 0 C.△H<0,△S>0 D.△H<0,△S<0 (4)将一定量的N2(g)和H2(g)放入 1L密闭容器中,在500℃、2×107Pa下达到平衡,测得N2为0.10mol,H2为0.30mol,NH3为0.10mol。计算该条件下达到平衡时H2转化为NH3的转化率 ,该温度下的平衡常数K值 。若升高温度,K值变化 (填“增大”、“减小”或“不变”)。 (5)在上述(4)反应条件的密闭容器中,欲提高合成氨中H2的转化率,下列措施可行的是 (填字母)。 A.向容器中按原比例再充入原料气 B.向容器中再充入惰性气体 C.改变反应的催化剂 D.分离出氨
17. (10分)(1)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色。分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH所致;乙同学认为是溶液中Na2CO3电离出的CO32-水解所致。请你设计一个简单的
实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论)
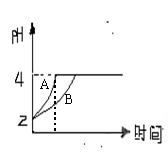 (2)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别
(2)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别
加入适量的Zn粒,反应过程中两溶液的pH变化如右图所示。
则图中表示醋酸溶液中pH变化曲线的是 (填“A”或“B”)。
设盐酸中加入的Zn质量为m1, 醋酸溶液中加入的Zn质量为m2。
则m1 m2(选填“<”、“=”、“>”)
 (3)在25℃下,向浓度均为0.1
mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________
沉淀(填化学式),生成该沉淀的离子方程式为____________
。(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP [Cu(OH)2]=2.2×10-20。)
(3)在25℃下,向浓度均为0.1
mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________
沉淀(填化学式),生成该沉淀的离子方程式为____________
。(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP [Cu(OH)2]=2.2×10-20。)
16. (13分)已知某无色溶液中只含有包括Na+、CH3COO-在内的四种离子,请回答下列问题:
(1)若该溶液中只含有一种溶质,则该溶液显 性。
相关的离子方程式为 。
(2)若该溶液呈酸性,则溶液中的溶质为 。
(3)若溶液中含有两种溶质,且溶液呈碱性,则该溶液中不可能出现的离子浓度大小关系是 。(选填编号字母)
A.c(Na+)>c(CH3COO-) B.c(CH3COO-)> c(Na+) C.c(OH-)> c(Na+)
D.c(Na+)> c(OH-) E.c(OH-)>c(CH3COO-) F. c(CH3COO-)> c(OH-)
(4)在稀氨水中存在下述电离平衡NH3+H2O NH3·H2O
NH3·H2O NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?(填“增大”“减小”或“不变”);平衡移动方向如何?
NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?(填“增大”“减小”或“不变”);平衡移动方向如何?
|
加入的物质 |
少量(NH4)2SO4固体 |
少量HNO3溶液 |
少量KOH溶液 |
|
c(OH-)的变化 |
① |
② |
③ |
|
平衡移动方向 |
④ |
⑤ |
⑥ |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com