
7.某500mL溶液中含0.1molFe2+、0.2molFe3+,加入0.2mol铁粉,待Fe3+完全还原后,溶液中Fe2+的物质的量浓度为(假设反应前后体积不变)
A.0.4mol/L B.0.6mol/L
C.0.8mol/L D.1.0mol/L
6.下列有关碱金属铷(Rb)的叙述中,不正确的是
A.灼烧氯化铷时,火焰有特殊颜色
B.硝酸铷是离子化合物,易溶于水
C.在钠、钾、铷三种单质中,铷的熔点最高
D.氢氧化铷是强碱
5.下列有关纯铁的描述正确的是
A.熔点比生铁的低
B.与相同浓度的盐酸反应生成氢气的速率比生铁的快
C.在潮湿空气中比生铁容易被腐蚀
D.在冷的浓硫酸中可钝化
4.等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为5∶6,则甲、乙两烧杯中的反应情况可能分别是
A.甲、乙中都是铝过量 B.甲中铝过量、乙中碱过量
C.甲中酸过量、乙中铝过量 D.甲中酸过量、乙中碱过量
3.在烧杯中加入水和苯(密度:0.88 g/cm3)各50 mL。将一小粒金属钠(密度:0.97 g/cm3)投入烧杯中。观察到的现象可能是
A.钠在水层中反应并四处游动
B.钠停留在苯层中不发生反应
C.钠在苯的液面上反应并四处游动
D.钠在苯与水的界面处反应并可能作上、下跳动
2.在氯化铁、氯化铜和盐酸混合溶液中加入铁粉,待反应结束,所剩余的固体滤出后能被磁铁吸引,则反应后溶液中存在较多的阳离子是
A.Cu2+ B.Fe3+ C.Fe2+ D.H+
1.下列块状金属在常温时能全部溶于足量浓HNO3的是
A.Ag B. Au C.Al D.Fe
28.(20分)有机物OPP是用途十分广泛的有机化工产品,广泛应用于杀菌防腐、印染助剂、表面活性剂、稳定剂和阻燃剂等领域。以烃A为原料可合成OPP:
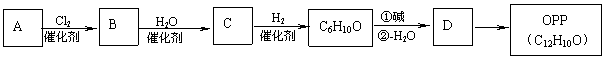
已知醛或酮在碱催化下可发生如下反应:


(1)①烃A是无色、带有特殊气味的液体。经实验测定,烃A中碳元素和氢元素
的质量比为mC: mH=12:1。烃A的结构简式为 。
②(填操作名称) 是分离、提纯液态有机物的常用方法,烃A就是用该方法从煤焦油中得到的基本化工原料。
(2)烃A生成有机物B的反应类型为 。
(3)①有机物C能与NaOH反应,反应的化学方程式为 。 ②有机物C与B浓溴水反应生成白色沉淀,可用于有机物C的定性检验和定
量测定,反应的化学方程式为 。
(4)有机物C6H10O的红外光谱图显示分子中含有C=O键,但是C6H10O不能发生银镜
反应。C6H10O的结构简式为 。
(5)有机物D的结构简式为 。
(6)有机物D在钯催化剂催化下进行脱氢反应得到OPP,OPP的红外光谱图显示分子中有O-H键和苯环。OPP的一种同分异构体E和OPP具有相同的基团,其核磁共振氢谱有6个峰,峰面积之比为1: 2:2:2:2:1,有机物E的结构简式
为 。
27.(16分).某课外小组在实验室制备氨气,并进行有关氨气的性质探究。
(1)该小组同学加热生石灰与氯化铵的混合物制取干燥的氨气。
①应该选用的仪器及装置有(填字母) 。

|
|
|
|
|
|
|
|
|

②生石灰与氯化铵反应生成氨气的化学方程式为 。
(2)该小组同学设计下图所示装置探究氨气的还原性。
|
|
|
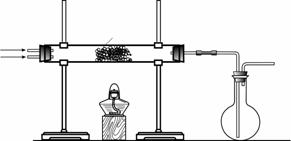
①氨催化氧化的化学方程式为 。
②若实验时通入氨气的速率过快,在烧瓶中会出现白烟,该物质的化学式为 。
(3)该小组同学以氨气和二氧化碳为原料制备碳酸氢铵。
①甲同学先将二氧化碳通入水中,充分溶解后,再通入氨气;乙同学先将氨气通入水中,充分溶解后,再通入二氧化碳。请选择合理的方案并说明原因。
。
②检验产物中有NH4+的方法为
。
26.(12分)近年来北京市汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物。
 (1)汽车内燃机工作时引起反应:N2(g)+O2(g)
(1)汽车内燃机工作时引起反应:N2(g)+O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向容积为2 L的密闭容器中充入10 mol N2与5 mol O2,达到平衡后NO的物质的量为2 mol,则T ℃时该反应的平衡常数K=
。(计算结果保留小数点后两位数字)
2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向容积为2 L的密闭容器中充入10 mol N2与5 mol O2,达到平衡后NO的物质的量为2 mol,则T ℃时该反应的平衡常数K=
。(计算结果保留小数点后两位数字)
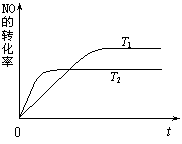
(2)一定量的NO发生分解的过程中,NO的转化率随时间变化的曲线如右图所示。(已知:T1<T2)
|
 N2(g)+O2(g)为(填“吸热”或“放热”)
反应。
N2(g)+O2(g)为(填“吸热”或“放热”)
反应。
②一定温度下,能够说明反应 2NO(g)  N2(g)+O2(g) 已达到平衡的是
N2(g)+O2(g) 已达到平衡的是
(填序号) 。
a.容器内的压强不发生变化
b.NO、N2、O2的浓度保持不变
c.NO分解的速率和NO生成的速率相等
d.单位时间内分解4 mol NO,同时生成2 mol N2
(3)①当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx,可用CxHy(烃)催化还原NOx消除氮氧化物的污染。
已知:CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ·mol-1
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) △H2
CH4(g)+2NO2(g) = N2(g)+CO2(g)+2H2O(g) △H3=-867 kJ·mol-1
△H2= 。
②使用催化剂可以将汽车尾气的主要有害成分一氧化碳(CO)和氮氧化物(NOx)转化为无毒气体,该反应的化学方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com