
22.(7分)
称取63.2 g KMnO4固体,先加热分解制取一定量的O2,再将剩余固体和足量36.5%,的浓盐酸( )混合加热制取Cl2。设收集到的O2为mol,收集到的Cl2为
)混合加热制取Cl2。设收集到的O2为mol,收集到的Cl2为 mol,最后Mn元素全部以Mn2+的形式存在于溶液中。
mol,最后Mn元素全部以Mn2+的形式存在于溶液中。
(1)如果配制上述500 mL浓盐酸,则需标准状况下HCl气体的体积为 L。
(2)当=0.16时,收集到Cl2的物质的量为 。

21.(9分)
某强酸性溶液X含有 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、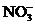 中的一种或几种离子,取该溶液进行连续实验,能实现如下转化:
中的一种或几种离子,取该溶液进行连续实验,能实现如下转化:

根据以上信息,请回答下列问题:
(1)上述离子中,溶液X肯定含有的离子是 ,不能确定是否含有的离子是 。
(2)气体D的化学式为 ,沉淀E的化学式为 ,沉淀H的化学式为 。
(3)反应①、②、③、④中,属于氧化还原反应的是 (填序号)。
20.(7分)
X、Y、Z分别为不同短周期元素组成的气态单质。在一定条件下能发生如下反应:
Y+X→甲(g),Y+Z→乙(g)。已知甲、乙相遇会产生白烟,且甲的相对分子质量小于乙。
(1)甲与乙反应的化学方程式为 。
 (2)磷在Z中燃烧可生成液态丙分子和固态丁分子。已知丙分子中各原子最外层均达到8电子稳定结构,则丙的电子式为
。
(2)磷在Z中燃烧可生成液态丙分子和固态丁分子。已知丙分子中各原子最外层均达到8电子稳定结构,则丙的电子式为
。
(3)磷单质和Z反应生成1 mol丙时,反应过程与能量变化如图所示,则该反应的热化学方程式为
。
(4)向一定浓度的BaCl2溶液中通入SO2气体,未见沉淀生成,若在通入SO2气体的同时通入某种纯净物气体,即可生成白色沉淀,则该气体可能是 (填“甲”或“乙”)。
19.(7分)
碘化钠是实验室中常见的分析试剂,常用于医疗和照相业。碘化钠在空气和水溶液中易变质而析出碘,工业上常用铁屑还原法来制备,工艺流程如下:

(1)碘元素位于元素周期表中第 周期 族。
(2)反应②中被氧化的元素是 。
(3)判断反应①中的碘是否已完全转化的具体操作方法是
。
(4)在将滤液浓缩、冷却、分离、干燥和包装的过程中,都需要注意的问题是
。
18.(8分)
某反应体系中的物质有:SnCl2、H3AsO3、H2SnCl6、As、HCl、H2O。已知H3AsO3在酸性介质中以氧化性为主。
(1)请将另外5种物质分别填入下列横线上,配平该反应的化学方程式。
=As+
(2)反应中被氧化的物质是 (填化学式),若得到1 mol还原产物,则转移的电子数为 。
(3)又知H3AsO3在碱性介质中以还原性为主。如pH=8时,H3AsO3能被12氧化为 ,则反应中还原剂与氧化剂的物质的量之比为
。
,则反应中还原剂与氧化剂的物质的量之比为
。
17. (10分)
(10分)
纯碱、烧碱等是重要的化工原料。
(1)利用如图所示装置可间接证明二氧化碳与烧碱溶液发生了反应。将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是
,反应的离子方程式为 。
若其他操作不变,将A与C连接,可观察到的现象是
。
(2)向100 mL2 mol·L-1NaOH溶液中通入一定量CO2,结晶后得到9.3g白色固体,该白色固体的组成是 (填化学式)。设计实验确定该白色固体中存在的阴离子,试完成下列方案:
|
实验操作 |
实验现象 |
结论 |
①取少量白色固体于试管中,加足量水溶解,再加足量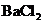 溶液 溶液 |
|
|
|
②过滤,取2mL滤液于试管中 ③ |
|
|
16.(7分)
某研究性学习小组为了解从工业溴中提纯溴的方法,查阅了相关资料:
溴是深红棕色液体,有刺激性气味;常温下易挥发;熔点一7.2℃,沸点58.78℃;密度3.119 g·cm-3;稍溶于冷水。
他们根据实验原理绘制了如下装置简图(固定夹持设备已省略):

请回答下列问题:
(1)仪器B的名称是 。
(2)根据实验原理,判断对装置A最适宜的加热方式为 。
(3)若要除去液溴中混有的少量Cl2,可在液溴中加入 (从下列试剂中选择,填序号)后再 (填一种实验操作方法)即可。
①饱和食盐水 ②NaOH浓溶液 ③饱和KI溶液 ④溴化钠溶液
(4)装置D中发生反应的离子方程式为 。
15.将一定量NaHCO3和Na2O2的混合物放在密闭容器中加热。下列关于混合物加热前后与盐酸完全反应,消耗HCl的物质的量的结论中正确的是
A.加热前消耗的多
B.加热后消耗的多
C.加热前后消耗的一样多
D.不知NaHCO3和Na2O2的含量,故无法确定
第II卷 (非选择题 共55分)
14.用NA表示阿伏加德罗常数的数值,下列说法中正确的是
A.0.1mol Na2O2与足量的水反应,转移电子数为0.2NA
B.由乙烯和丙烯组成的混合物1.4 g中含有的碳原子数为0.1 NA
C .2.24 L(标准状况下)Cl2与足量的NaOH溶液在常温下反应,转移的电子数为0.2 NA
D.pH=13的NaOH溶液中,含有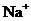 个数为0.1 NA
个数为0.1 NA
13.下列离子方程式书写正确的是
A.碳酸氢铵和足量的氢氧化钠溶液反应:
B.金属钠投入CuSO4溶液中: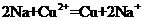
C.向次氯酸钙溶液中通入少量CO2: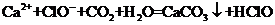
D.FeSO4酸性溶液暴露在空气中:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com