
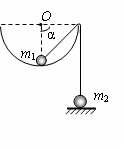
4.如图所示,一个半球形的碗放在桌面上,碗口水平,O点为其球
心,碗的内表面及碗口是光滑的。一根细线跨在碗口上,线的两端分别系有质量为m1和m2的小球。当它们处于平衡状态时,质量为m1的小球 与O点的连线与水平线的夹角为α=90°,质量为m2的小球位于水平地面
与O点的连线与水平线的夹角为α=90°,质量为m2的小球位于水平地面 上,设此时质量为m2的小球对地面压力大小为N,细线的拉力大小为T,则 ( )
上,设此时质量为m2的小球对地面压力大小为N,细线的拉力大小为T,则 ( )
A.N= B.N=m2g C.T=
B.N=m2g C.T=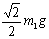 D.T=
D.T=


3.如图所示,粗糙的斜面M放在粗糙的水平面上,物块m恰好能在斜面体上沿斜面匀速下滑,斜面静止不动。若用平行斜面向下的力推动物块,使物块加速下滑,则斜面( )

A.受地面的摩擦力大小为零


B.受地面的摩擦力方向水平向右

C.受地面的摩擦力方向水平向左

D.在F的作用下,斜面可能沿水平面向右运动

2.物体静止在光滑水平面上,先对物体施一水平向右的恒力F1,经t秒后物体的速率为v1时撤去F1,立即再对它施一水平向左的水平恒力F2,又经2t秒后物体回到出发点,此时速率为v2,则v1、v2间的关系是 ( )
A.v1=v2 B.2v1=v2 C.3v1=2v2 D.5v1=3v2
1.如图为两个物体A和B在同一直线上沿同一方向同时作匀加速运动的v-t图线。已知在 第3s末两个物体在途中相遇,则物体的出发点的关系是( )
第3s末两个物体在途中相遇,则物体的出发点的关系是( )
A.从同一地点出发 B.A在B前3m处 
C.B在A前3m处
D.B在A前5m处
20.(12分)工业上以黄铁矿为原料生产硫酸,其中重要的一步是催化氧化:
2SO2(g)+O2 (g) 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1
(1)生产中为提高反应速率和SO2的转化率,下列措施可行的是 (填字母)。
A.向装置中充入N2
B.向装置中充入过量的O2
C.使用更高效的催化剂
D.升高温度
(2)在一恒容密闭容器中充入4 mol SO2和一定量O2,当放出353.6 kJ热量时,SO2的转化率最接近于 (填字母)。
A.40% B.50% C.80% D.90%
(3)580℃时,在一恒容密闭容器中充入一定量的SO2和O2,当反应达到平衡后测得SO2、O2和SO3的物质的量浓度分别为6.0×10-3 mol·L-1、8.0×10-3 mol·L-1和4.4×10-2 mol·L-1。
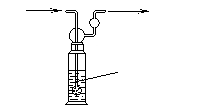
该温度下反应2SO2(g)+O2 (g) 2SO3(g)的平衡常数K= 。保持温度不变,若起始向上述容器充入SO2、O2和SO3的物质的量浓度分别为2.0×10-3 mol·L-1、1.0×10-2 mol·L-1和7.0×10-2 mol·L-1,则反应将向
方向进行。
2SO3(g)的平衡常数K= 。保持温度不变,若起始向上述容器充入SO2、O2和SO3的物质的量浓度分别为2.0×10-3 mol·L-1、1.0×10-2 mol·L-1和7.0×10-2 mol·L-1,则反应将向
方向进行。
(4)硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时需要加以处理后才能排放。现用右图所示装置测定尾气中SO2的含量,当通入尾气11.2 L(标准状况下测定)时,碘水恰好褪色。通过计算说明,该尾气能否直接排放(写出计算过程)。
舒城中学2009-2010学年度第一学期期中考试
19.(9分)5·12大地震后在灾区使用了多种消毒剂,高锰酸钾是其中之一。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。

(1)KMnO4稀溶液是一种常用的消毒剂。其消毒机理与下列物质相同的是______(填代号)。
a. 84消毒液(NaClO溶液) b. 双氧水 c. 苯酚 d. 75%酒精
(2)高锰酸钾保存在棕色试剂瓶,下列试剂保存不需要棕色试剂瓶的是_______(填代号)。
a. 浓硝酸 b. 硝酸银 c. 氯水 d. 纯碱
(3)上述流程中可以循环使用的物质有______________、______________(写化学式)。
(4) 该生产中需要纯净的CO2气体。若实验室要制备纯净的CO2所需试剂最好选择___________(选填代号)。 a. 石灰石 b. 稀HCl c. 稀H2SO4 d. 纯碱
所需气体发生装置是_____________(选填代号)。
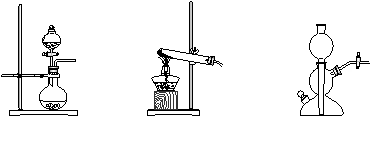
(5)操作Ⅰ的名称是_____________;操作Ⅱ是根据KMnO4和K2CO3两物质在__________(填性质)上的差异,采用____________(填操作步骤)、趁热过滤得到KMnO4粗晶体的。
18.(10分)(1)由氢气和氧气反应生成1 mol水蒸气放热241.8 kJ,写出该反应的热化学方程式____________________________________。若1g水蒸气转化成液态水放热2.444 kJ,则反应2H2(g)+ O2(g) === 2H2O(l)的△H=_______________,氢气的燃烧热为_______________。氢氧燃料电池是符合绿色化学理念的新型发电装置,写出用KOH作为电解质溶液的负极反应式 。
(2)已知0.5 mol甲烷与0.5 mol水蒸气在t ℃.p kPa时,完全反应生成一氧化碳和氢气,吸收了a kJ热量,该反应的热化学方程式是: 。
17.(16分)A、B、C、D四种均为短周期元素,原子序数依次增大
(1)A元素原子最外层电子数是核外电子层数的3倍,A与D同主族,A和D可形成两种化合物X和Y,X和水反应后生成一种具有还原性的二元酸M,M可以使溴水褪色。
(2)A元素的单质和C元素的单质化合可生成Z, Z在加热条件下跟水反应的产物1 mol需用3mol KOH才能完全中和。
(3)A元素的单质和B元素的单质一定条件下反应生成化合物N,D元素的单质和B元素的单质反应生成化合物G,化合物N和化合物G的相对分子质量相等,且焰色反应均呈黄色。
回答下列问题:
(1)画出元素D的离子结构示意图:__________
___;写出元素D的原子核外电子排布式

(2)A、B、C、D四种元素的原子半径按由小到大排列的顺序为(用相应的元素符号表示):
_____________________________ ____
(3)M可以使溴水褪色,写出该反应的离子方式 ;
(4)Z与热水反应的化学方程式
。
(5)化合物N与化合物G的水溶液反应,若氧化剂与还原剂物质的量之比为1:1,该反应的离子方程式为
(6)常温下,D的氢化物呈气态,有毒,水溶液呈酸性。脱除天然气中D的氢化物既能减少环境污染,又可回收D的单质。
用过量NaOH溶液吸收D的氢化物后,以石墨作电极电解该溶液可回收D的单质,其电解总反应的化学方程式(忽略溶解氧的氧化还原反应)为__________ ;
该方法的优点是_______________ _____ 。
16. (8分)某溶液由Na+、Cu2+、Fe3+、AlO2-、CO32-、SO42-、Cl-中的若干种离子组成。取适量该溶液进行如下实验:

①向其中加入过量的盐酸,有气体生成,并得到无色透明的溶液

②在①所得的溶液中加入过量氨水,产生白色沉淀,过滤;

③在②所得的滤液中加入过量Ba(OH)2溶液,产生白色沉淀,过滤;

④在③所得的滤液中加入过量稀硝酸,再加入硝酸银溶液,产生白色沉淀。

根据以上实验回答下列问题:

(1)据①可知溶液中肯定存在的离子是
。

(2)③中反应的离子方程式为
。

(3)溶液中肯定不存在的离子是
。

(4)溶液中一定存在的溶质是
。

15.已知在硫酸铝、硫酸钾和明矾的混合溶液中,C(SO42-)=0.2mol/L,若向其中加入等体积0.2mol/L的KOH溶液(混合后体积变化忽略不计),恰好使所生成的沉淀完全溶解,则所得溶液中的C(K+)为(
)
A .0.250mol/L B. 0.225mol/L
C .0.150mol/L D.0.450mol/L

第II卷(非选择题 共55分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com