
27.(12分)
绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:

已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
(1)检验制得的绿矾晶体中是否含有Fe3+的实验操作是______________________
________________________________________________________。
(2)操作II中,通入硫化氢至饱和的目的是_____________________________________;在溶液中用硫酸酸化至pH=2的目的是___________________________________。
(3)操作IV的顺序依次为:__________________、冷却结晶、___________________。
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②_________________________________________________________。
(5)测定绿矾产品中Fe2+含量的方法是:a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL(滴定时发生反应的离子方程式为:5Fe2++MnO4¯+8H+→5Fe3++Mn2++4H2O)。
①判断此滴定实验达到终点的方法是___________________________。
②计算上述样品中FeSO4·7H2O的质量分数为__________(用小数表示,保留三位小数)。
③若用上述方法测定的样品中FeSO4·7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有_________________;_________________________。
26.(12分)某化学课外活动小组在实验室设计了如下图所示的实验装置,进行“氨的催化氧化”实验。
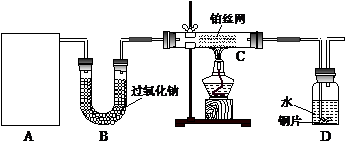
(1)A处是气体发生装置,A中所用的试剂只能从下列物质中选取:
①硝酸铵;②碳酸铵;③碳酸氢铵;④氯化铵;⑤熟石灰;⑥氢氧化钠。
若A中制取气体时只用了一种药品,则该药品可以是_______________(填选项编号),在只用一种药品制取氨气时,图中空白处所需仪器应为____________________(选填下列仪器编号,固定装置省略)。

(2)该装置补充完整后,仍然存在一定缺陷,试从安全与环保的角度来考虑,对该装置进行改进:
①__________________________________________________________;
②________________________________________________________。
(3)按照改进后的装置进行实验,请完成以下问题:
①装置B的作用_________________________________________________;
②写出C中发生反应的化学方程式:_______________________________;
③若A、B处试剂足量,则装置D中可以观察到的实验现象有______________。
25.(8分)已知可逆反应:Fe(s) + CO2(g) FeO(s) + CO(g),其温度与平衡常数K的关系如下表:
FeO(s) + CO(g),其温度与平衡常数K的关系如下表:
|
T(K) |
938 |
1173 |
|
K |
1.47 |
2.15 |
(1)写出该反应的平衡常数表达式____________________。
(2)若该反应在体积固定的密闭容器中进行,在一定条件下达到
平衡状态,改变下列条件再达平衡后判断(选填“增大”、“减
小”、“不变”):
①升高温度,混合气体的平均相对分子质量_________;
②充入氦气,混合气体的密度__________。

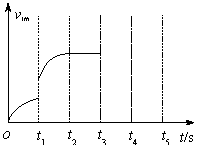
 (3)该反应的逆反应速率随时间变化情况如右图所
(3)该反应的逆反应速率随时间变化情况如右图所
示。
①从右图可知,在t1时改变了某种反应条件,
反应在t2时达到平衡,改变的条件可能是
_______(选填编号)。
a.升高温度 b.增大CO2的浓度
c.减小CO2的浓度 d.使用催化剂
②如果在t3时增加CO2的量,t4时反应又处于新
平衡状态,请在上图 画出t3~ t5时间段的v逆变化
画出t3~ t5时间段的v逆变化
曲线。
③能作为判断该反应达到平衡状态的依据是_______(选填编号)。
a.v正(CO2)=v逆(CO) b.容器内气体总压强不再变化
c.容器内气体密度不再变化 d.使用催化剂后,正、逆反应速率同比例加快
24.(8分)
近年来,我国储氢纳米碳管研究获得重大进展,电弧法合成的碳纳米管,常伴有大量的物质--碳纳米颗粒。这种碳纳米颗粒可用氧化气化法除去,同时生成的产物对环境不会产生污染。在整个反应体系中除了碳单质外,还有K2Cr2O7 、K2SO4、Cr2(SO4)3、H2SO4、H2O和X。
(1)根据题意,可判断出X是____________(写化学式)。
(2)在反应中,氧化剂应是____________(写化学式),硫酸的作用是_____________。
(3)写出并配平该反应的化学方程式,并标出电子转移的方向和数目。
(4)在上述反应中,若产生22 g X物质,则反应中转移的电子数目为_____________。
23.(8分)钠、镁、铝是重要的金属元素,与我们的生活和生产关系密切。
(1)元素的性质特别是化学性质取决于元素原子结构。钠离子的电子排布式为_______,铝元素的原子结构示意图为_________。
(2)钠、镁、铝元素的阳离子半径由小到大的顺序是_____________(用离子符号表示)。在短周期中非金属性最强的元素位于第____周期____族。
(3)钠、镁、铝的单质及其化合物在某些性质上存在着递变规律。下列有关说法正确的是___________(选填编号)。
a.三种元素的金属性越强,金属单质的熔点就越高
b.其碱性按NaOH、Mg(OH)2、Al(OH)3顺序依次减弱
c.常温下都能与浓硝酸剧烈反应生成硝酸盐,但剧烈程度依次减弱
d.等质量的钠、镁、铝与足量稀硫酸反应生成氢气的物质的量依次增加
(4)1932年,美国化学大师Linus Pauling提出电负性(用希腊字母χ表示)的概念,用来确定化合物中原子某种能力的相对大小。Linus Pauling假定氟元素的电负性为4,并通过热化学方法建立了其他元素的电负性。第三周期主族元素的电负性如下:
|
元素 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
|
电负性 |
0.9 |
1.2 |
1.5 |
1.8 |
2.1 |
2.5 |
3.0 |
从上表可以看出电负性的大小与元素非金属性的强弱关系是_________________;大量事实表明,当两种元素的χ值相差大于或等于1.7时,形成的化合物一般是离子化合物,根据此经验规律,AlBr3中的化学键类型应该是_________________。
22.已知硫铁矿在沸腾炉中煅烧时通入的气体原料是空气,且空气中N2的体积分数为0.8,O2的体积分数为0.2,则从沸腾炉排出的气体中SO2的体积分数可能是 ( )
A.0.10 B.0.12 C.0.16 D.0.20
第Ⅱ卷(共84分)
21.右图是一套实验室制备气体的装置,
用于发生、干燥、收集和吸收有毒
气体。下列各组物质能利用这套装
置进行实验的是 ( )
A.电石和水
B.MnO2和浓盐酸
C.Cu片和浓硝酸
D.Na2SO3和浓硫酸
20.常温下,在a、b、c三个盛有相同体积、相同浓度的稀H2SO4的烧杯中,分别加入等质量的表面积相同的锌。然后在a中同时加入适量CuSO4溶液,c中加入适量的无水CH3COONa固体。下列各图中表示其产生氢气总体积(V)与时间(t)的关系,其中可能正确的是 ( )


A B C D
19.化学中常借助曲线图来表示某种变化过程,如有人分别画出了下列的四个曲线图:

有关上述曲线图的说法正确的是 ( )
A.曲线图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化
B.曲线图②可以表示向一定量的盐酸中滴加一定浓度的氢氧化钠溶液时的pH的变化
C.曲线图③可以表示向一定量的明矾溶液中滴加一定浓度的氢氧化钡溶液时的产生沉淀的物质的量变化
D.曲线图④可以表示所有的固体物质溶解度随温度的变化
18.下列反应的离子方程式正确的是 ( )
A.向碳酸氢钙溶液中加入少量氢氧化钠:
Ca2+ +2HCO3-+2OH-→CaCO3↓+2H2O+CO32-
B.等体积、等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:
Ba2+ +2OH-+NH4+ +HCO3-→BaCO3↓+NH3·H2O+H2O
C.碳酸钠溶液中通入少量二氧化碳气体:CO32-+CO2+H2O→2HCO3-
D.Fe2+、NaI混合溶液中加入足量氯水:2I-+Cl2→2Cl-+I2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com