
3、“一国两制”的理论与实践:“一国两制”的构想;香港、澳门的回归;海峡两岸关系的发展。
1、中华人民共和国的成立与民主政治制度的建设:中华人民共和国的成立;中国共产党领导的多党合作和政治协商制度的形成;人民代表大会制度的创立;民族区域自治制度的建立。
21.(10分)铁元素及其化合物与人类的生产生活息息相关,
试回答下列问题:
(1)电子工业常用30%,的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板,写出该反应的离子方程式 。
 (2)高炉炼铁过程中会发生反应:FeO(s)+CO(g) Fe(s)+CO2(g)。
(2)高炉炼铁过程中会发生反应:FeO(s)+CO(g) Fe(s)+CO2(g)。
已知:Fe(s)+ O2(g)=FeO(s)△H=-272kJ·mol-1
O2(g)=FeO(s)△H=-272kJ·mol-1
C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1
2C(s)+O2(g)=2CO(g) △H=-22lkJ·mol-1
 则:①FeO(s)+CO(g)
Fe(s)+CO2(g) △H= 。
则:①FeO(s)+CO(g)
Fe(s)+CO2(g) △H= 。
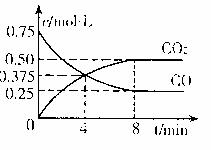 ②一定温度下,向某密闭容器中加人足量FeO,并充人一定量的CO气体,反应过程中CO和CO2的浓度与时间的关系如图所示
②一定温度下,向某密闭容器中加人足量FeO,并充人一定量的CO气体,反应过程中CO和CO2的浓度与时间的关系如图所示
则从开始至达到平衡过程中, (CO)=
(CO)=
;该温 度下,
 FeO(s)+CO(g) Fe(s)+CO2(g)
FeO(s)+CO(g) Fe(s)+CO2(g)
的化学平衡常数K= 。
(3)铁红是一种红色颜料,其成份是Fe2O3。将一
定量的铁红溶于160mL5mol·L-1盐酸中,再加
人一定量铁粉恰好完全溶解,收集到气体2.24L(标准状况),经检测,溶液中无Fe3+,则参加反应的铁粉的质量为 。
[选做部分]
共2个题,考生从中选择1个作答,若两题都做。只对第1题判分。
选做[物质结构与性质](10分)
(1)图l表示元素X的前五级电离能的数值示意图。
已知X的原子序数<20,请写出X的电子排布式 。
 (2)A、B、C、D、E、F、G、H八种短周期元素,其单质的沸点如图2所示。
(2)A、B、C、D、E、F、G、H八种短周期元素,其单质的沸点如图2所示。
请回答:
①上述元素中,某些元素的常见单质所形成的晶体为分子晶体,这些单质分子中既含有 键又含有
键又含有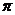 键的是
(填化学式)。
键的是
(填化学式)。
②已知D、F、G三种元素的离子具有跟E相同的电子层结构,则B、C、D三种元素的第一电离能由大到小的次序为(用相关元素符号表示): > > 。
③已知H的电负性为1.5,而氯元素的电负性为3.0,二者形成的化合物极易水解,且易升华。据此推测该化合物的化学键类型为 。
④原子序数比A小l的元素与D元素形成的化合物的空间构型为 ,中心原子的杂化方式为 。
选做[有机化学基础](10分)
以HCHO和CH2 CH为有机原料,经过下列反应可得化合物N(C4H8O2)。
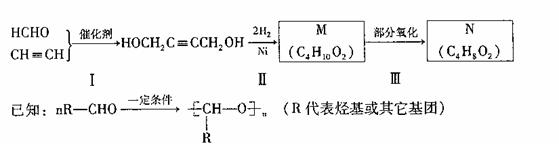
 A与M互为同分异构体,A能发生如下转化:
A与M互为同分异构体,A能发生如下转化:
填写下列空白:
(1)反应I的反应类型为 。
(2)N的同分异构体中,属于酯类的有 种。
(3)A的结构简式为 ,B中的官能团名称是 。D化学式为 。
(4)写出B与银氨溶液反应的化学方程式(有机物用结构简式表示):
20.(10分)研究化学反应原理对于生产生活是很有意义的。
(1)下列关于醋酸的叙述正确的是 (填写符号)。
a.醋酸俗名冰醋酸,是食醋的主要成分
 b.向醋酸溶液中加入一定量NaOH固体,溶液的导电性增强
b.向醋酸溶液中加入一定量NaOH固体,溶液的导电性增强
c.加水稀释醋酸溶液,溶液中的所有离子浓度均减小
d.常温下,醋酸溶液中水的电离程度减小
(2)牙釉质对牙齿起着保护作用,其主要成分为
Ca5(PO4)3OH,该物质在水中存在沉淀溶解
平衡,试写出该物质的溶度积常数表达式
Kap= 。
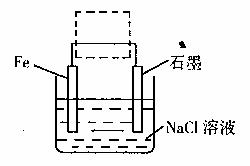
(3)钢铁生锈现象随处可见,钢铁的电化腐蚀原理
如图所示:
①写出石墨电极的电极反应式 ;
②将该装置作简单修改即可成为钢铁电化学防护的装置,请在右图虚线框内所示位置作出修改,并用箭头标出导线中电子流动方向。
③写出修改后石墨电极的电极反应式 。
19. (11分)已知:A、B、C、D四种短周期元素,A与D的原子序数之和等于B与C的原子序数之和,由D元素组成的单质在通常状况下呈黄绿色,B、C、D三种元素位于同一周期,A、B、C三种元素的最高价氧化物对应的水化物分别为X、Y、Z,且存在如下转化关系,试推断回答下列问题:
(11分)已知:A、B、C、D四种短周期元素,A与D的原子序数之和等于B与C的原子序数之和,由D元素组成的单质在通常状况下呈黄绿色,B、C、D三种元素位于同一周期,A、B、C三种元素的最高价氧化物对应的水化物分别为X、Y、Z,且存在如下转化关系,试推断回答下列问题:
(1)D元素原子的结构示意图为 。
(2)A、B、C三种元素的原子半径由小到大的顺序为 (用元素符号表示)
(3)Y与C元素的最高价氧化物可以发生反应,该反应的离子方程式为 。
(4)A与D元素的气态氢化物之间可以反应生成一种盐,该盐的水溶液呈 (“酸”、“碱”或“中”)性,该水溶液中各离子浓度由小到大的顺序为 (用具体离子符号表示)。
(5)实验室中,应将x的浓溶液保存在棕色试剂瓶中,其原因是 (用化学方程式表示)。
18.(11分)某同学用废干电池内的黑色固体(可能含有MnO2、NH4Cl、ZnCl2等物质)进行如下实验:
|
|
|


 黑色固体 溶解
过滤 固体灼烧
黑色固体 溶解
过滤 固体灼烧
(1)上述三步操作中都用到的一种玻璃仪器是 。
(2)将灼烧后的固体移人试管,滴加双氧水,能迅速产生一种使余烬的木条复燃的气体,由此推断黑色固体中含有MnO2,它在该反应中作用为 ,写出该反应的化学方程式 。MnO2有一定的氧化性,请写出一个MnO2作氧化剂的反应的化学方程式 。
(3)验证步骤②的滤液中含有NH4+,下面是某一实验方案记录片断。请填写下列空白:
实验过程: 。
实验现象:有刺激性气味的气体产生。
写出该实验中反应的离子方程式 。
17.(8分)化学是一门以实验为基础的科学。
(1)下列叙述正确的是 (填写序号)。
①将0.2mol·L-1FeCl3溶液滴加到沸水中,然后继续加热并不断搅拌可制得氢氧化铁胶体。
②将95g的蒸馏水,倒人盛有5g氯化钠的烧杯中,搅拌溶解,配制5%的食盐水。
③用苯萃取溴水中的Br2,分液时,苯层从分液漏斗的下口放出。
④使用容量瓶、滴定管、分液漏斗时,首先应检验是否漏水。
⑤将混合气体通过盛有饱和Na2CO3溶液的洗气瓶,除去CO2中HCl。
(2)A、B、C、D四种固体均可溶于水,组成它们的阳离子为:Na+、Mg2+、Al3+、Ba2+;阴离子为:OH-、Cl-、CO32-、SO42-。分别取它们的水溶液进行实验,结果如下:
①A与B、C、D反应均可产生白色沉淀;
②B溶液与适量的D溶液反应生成白色沉淀,加入过量的D溶液时,沉淀量减少但不消失。则A为 C为 (填写化学式);
B溶液与NaHCO3溶液反应的离子方程式为 。
16.在恒温、恒压下,a mol A和b molB在一个容积可变的容器中发生反应:
 A(g)+2B(g) 2C(g),一段时间后达到平衡,生成n mol C。则下列说法中正确的是 ( )
A(g)+2B(g) 2C(g),一段时间后达到平衡,生成n mol C。则下列说法中正确的是 ( )
A.物质A、B的转化率之比为l:2
B.起始时刻和达到平衡后容器中的压强之比为(a+b):(a+b- )
)
C.当2v正(A)=v逆(B)时,反应一定达到平衡状态
D.充入惰性气体(如Ar),平衡向正反应方向移动
第Ⅱ卷(非选择题,共60分)
[必做部分]
15.某同学按下图所示的装置进行实验。A、B为两种常见金属,它们的硫酸盐可溶于水。当K闭合时,SO42-从右向左通过交换膜移向A极。下列分析正确的是 ( )
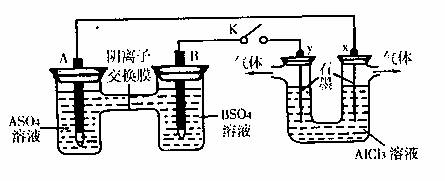
A.溶液中c(A2+)减小
B.B的电极反应:B→B2++2e-
C.y电极上有H2产生,发生还原反应
D.反应初期,x电极周围出现白色胶状沉淀
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com