
(三)方案设计与探究实施
用烧杯取少量样品,将一颗光亮的铁钉放入烧杯,浸泡一段时间。观察到的现象,
假设:①.有明显现象;②.无明显现象。
(4)基于假设①,结论是铁钉被腐蚀,预期的实验现象是__ ____。
(5)基于假设②,结论是可能被腐蚀,但现象不明显,请设计实验进一步验证该结论,叙述实验操作:_ __。
28、有机物A(C10H20O2)具有兰花香味。已知:

①B分子中没有支链。
②D能与碳酸氢钠溶液反应放出二氧化碳。
③D、E互为具有相同官能团的同分异构体。E分子烃基上的氢若被Cl取代,其一氯代物只有一种。④F可以使溴的四氯化碳溶液褪色。
(1)B可以发生的反应有 (选填序号)。
①取代反应 ②消去反应 ③加聚反应 ④氧化反应
(2)D、F分子所含的官能团的名称依次是 、 。
(3)写出与D、E具有相同官能团的同分异构体的可能结构简式:
。
(4)B与E反应生成A的化学反应方程式
(5)某学生检验C的官能团时,取1mol/LCuSO4溶液和2mol/LNaOH溶液各1mL,在一支洁净的试管内混合后,向其中又加入0.5mL40%的C,加热后无红色沉淀出现。该同学实验失败的原因可能是 (选填序号)
①加入的C过多 ②加入的C太少
③加入CuSO4溶液的量过多 ④加入CuSO4溶液的量不够
(二)对该消毒液提出探究的问题:它对碳钢制品是否有腐蚀作用?
(一)从以上材料获得的信息有:
(1)该消毒液的酸碱性:________,原因是(用离子方程式表示)________。
(2)该消毒液可能具有的化学性质是_________性和________性(任意写出两种)。
(3)写出其中一种因素引起该消毒液失效涉及的化学反应方程式__ __。
7.我国08年遭遇了特大雪灾,我国科学家用氯化钙、尿素、葡萄糖酸钠等为原料成功研制出一种新型复合融雪剂。下列说法正确的是
A.传统的氯化钠融雪剂通过升高水的凝固点实现雪融化
B.传统的氯化钠融雪剂由于价格偏高而减少使用
C.葡萄糖酸钠是强电解质
D.尿素通过CO2与NH3发生化合反应制得
8.用硫酸铁电化浸出黄铜矿精矿工艺中,精矿在阳极浸出的反应比较复杂,其中有一主要反应:CuFeS2+4Fe3+=Cu2++5Fe2++2S。下列说法正确的是
A.反应中硫元素被氧化,所有铁元素均被还原 B.还原剂是Fe3+,氧化剂是S2-
C.氧化产物是S,还原产物是Cu2+和Fe2+
D.当转移1mol电子时,46 g CuFeS2参加反应
9.设NA为阿伏加德罗常数。下列叙述中正确的是
A.标准状况下,22.4 L CO2和O2混合气体中含有的氧原子数约为NA
B.2 mol SO2和1 molO2 混合在V2O5存在条件下的密闭容器中反应,反应后分子总数大于2 NA
C.常温常压下,0.1 mol铁在0.1 mol Cl2中充分燃烧,转移的电子数为0.3 NA
D.1 L 1 mol/L的K2CO3溶液中离子总数小于3NA
10.能在溶液中大量共存,加入(NH4)2Fe(SO4)2·6H2O晶体后仍能大量存在的离子组是
A.Na+、H+、Cl-、NO3- B.K+、Ba2+、OH-、I-
C.Na+、Mg2+、Cl-、SO42- D.Cu2+、S2-、Br-、ClO-
11. 右图是一种形状酷似罗马两面神Janus的有机物结构简式,化学家建议将该分子叫做“Janusene”,有关Janusene的说法正确的是
右图是一种形状酷似罗马两面神Janus的有机物结构简式,化学家建议将该分子叫做“Janusene”,有关Janusene的说法正确的是
A.Janusene的分子式为C30H20
B.Janusene属于苯的同系物
C.Janusene苯环上的一氯代物有8种
D.Janusene既可发生氧化反应,又可发生还原反应
12. 根据下列实验现象,所得结论正确的是
根据下列实验现象,所得结论正确的是
A B C D
|
实验 |
实验现象 |
结论 |
|
A |
左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 |
活动性:Al>Fe>Cu |
|
B |
左边棉花变为橙色,右边棉花变为蓝色 |
氧化性:Cl2>Br2>I2 |
|
C |
白色固体先变为淡黄色,后变为黑色 |
溶解性:Ag2S>AgBr>AgCl |
|
D |
锥形瓶中有气体产生,烧杯中液体变浑浊 |
非金属性:Cl>C>Si |
13.常温下,一定量的醋酸与氢氧化钠溶液发生中和反应。下列说法正确的是
A.当溶液中c(CH3COO-) = c(Na+)时,醋酸与氢氧化钠恰好完全反应
B.当溶液中c(CH3COO-) = c(Na+)时.一定是氢氧化钠过量
C.当溶液中c(CH3COO-) = c(Na+)>c(H+) = c(OH-)时,一定是醋酸过量
D.当溶液中c(Na+)>c(CH3COO-) >c(OH-)>c(H+)时,一定是氢氧化钠过量
第Ⅱ卷
25.(13分)A、B、C、D为4种常见的短周期元素,常温下A、B可形成两种液态化合物,其最简式分别为BA和B2A;B与D可形成分子X,也可形成阳离子Y,X、Y在水溶液中酸、碱性正好相反;C+的焰色反应呈黄色。
(1)液态X类似B2A,也能微弱自电离产生电子数相同的两种离子,则液态X的电离方程式为:_________________ _____。
(2)M、N是由A、B、C、D四种元素中任意三种组成的不同类型的强电解质,M的水溶液呈碱性,N的水溶液呈酸性,且物质的量浓度相等的M、N溶液中水的电离程度前者小于后者。则M、N分别为(填化学式) ___________、___________;用化学用语分别说明M的水溶液呈碱性、N的水溶液呈酸性的原因: 、 ;若将0.1mol·L-1 M和0.2mol·L-1 N两种溶液等体积混合后所得溶液中离子浓度的大小顺序为:_______________________________________。
(3)氮可以形成多种离子,如N3-、N3-、NH2-、NH4+、N2H5+、N2H62+。N2H6+是由中性分子结合质子形成的,有类似于NH4+的性质。写出Na3N与水反应的化学方程式:_______________________________。② 离子化合物NH5的电子式为:___________ ,写出该物质在低温下与水反应的化学方程式 ,
③
写出N2H 离子与过量强碱溶液反应的离子方程式:_______ __________
。
离子与过量强碱溶液反应的离子方程式:_______ __________
。
26.(15分)下图中的A~H是中学化学中常见的八种物质,所有物质均由短周期元素组成,其中B、F、H都含有同一种元素;B、D、E为单质、其他为化合物,常温常压下C为无色液体,D、E为气体;H的晶体熔点高、硬度大、闪烁着晶莹的光泽。A~H之间的转化关系如图所示。

⑴H的化学式为 、A的电子式为 ;
⑵A、B的混合物加C后,可能发生的反应的化学方程式为 、
。
⑶向F溶液中逐渐滴入盐酸直至过量,若看到的现象是先出现白色沉淀后沉淀消失,写出符合现象的离子方程式 ,与之对应的D、E恰好完全反应生成C时A与B的物质的量之比为: ;
27.(16分)某品牌消毒液包装说明中的部分内容摘录如下:
主要有效成份为次氯酸钠,有效氯含量8000-10000mg/L。可用于各类家居用品、餐具、棉织衣物等的消毒,对彩色织物可能有褪色作用。切勿用于丝绸、毛、尼龙、皮革、油漆表面,勿用于铝、铜、碳钢制品。本品须密封,置阴凉暗处保存。
33、(14分)果蝇是研究遗传学问题的良好材料,请回答:
⑴果蝇的体细胞中有4对染色体,在精子的形成过程中,会出现两次染色体排列在细胞中央的情形。第一次染色体排列在细胞中央的时期是 ,此时细胞中有 个着丝粒。
⑵摩尔根从野生果蝇培养瓶中发现了一只白眼雄性个体。他将白眼♂与红眼♀杂交,F1全部表现为红眼。再让F1红眼果蝇相互交配,F2性别比为1:1,红眼占3/4,但所有雌性全为红眼,白 眼只限于雄性。为了解释这处现象,他提出了有关假设。你认识最合理的假设是
。
眼只限于雄性。为了解释这处现象,他提出了有关假设。你认识最合理的假设是
。
⑶假定残翅(v)基因频率为10-5,由于在正常环境条件下,残翅果蝇难以生存,结果长翅(V)类型个体逐渐增多,V基因频率也随之升高,经过许多代后,长翅类型成为该种群中常见类型。与其他突类型相比,残翅个体数要少得多,这一现象说明  。如果在某果蝇种群中,每2500只果蝇中才有一只残翅果蝇,那么残翅(v)的基因频率为
。
。如果在某果蝇种群中,每2500只果蝇中才有一只残翅果蝇,那么残翅(v)的基因频率为
。
⑷将果蝇的一个细胞放入含15N的脱氧核苷酸培养液中,待细胞分裂到第二个周期的中期,取出放射自显影后,观察某一条染色体的两条姐妹染色单体,发现一条染色单体的两条脱氧核苷酸链中,只有一条链含有放射性,则另一条染色单体有 条链含有放射性。
⑸遗传学家曾做过这样的实验:长翅果蝇幼虫正常的培养温度为25℃,如果将孵化后4-7天的长翅果蝇幼虫在35℃~37℃处理6-24h,可得到某些残翅果蝇,这些残翅果蝇在正常环境温度下产生的后代仍然是长翅果蝇。针对上述实验现象,结合基因与酶的关系及酶的特性作出合理的解释: 。



(1)加成反应或还原反应(2分) 消去反应(2分)
(2)HOOCC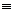 CCOOH(3分)
CCOOH(3分)

(3分)

32、 (12分)下列是某种
(12分)下列是某种 雌激素分泌及作用机制模式图。请结合所学知识及图中有关信息,回答问题。
雌激素分泌及作用机制模式图。请结合所学知识及图中有关信息,回答问题。
(1)结构A是 ,结构C是 ;结构ABC中具有神经传导和激素分泌双重功能的是 (用图中字母表示)。物质b是 ,物质e是 ;
(2)过程①通过的方式是 ,细胞质受体、核受体与细胞膜上受体的物质属性及功能相似,因此,细胞质和细胞核受体的物质成分应是 ,导致细胞质受体与核受体差异的直接原因是 。
(3)②是 过程,若将物质e导入其他高等运动细胞中,结果高等运动细胞中也能合成相同物质f,这一现象说明 。
30.(16分) 与有机物B相关的反应信息如下:

(1)写出下列反应的反应类型:
 B→A______________,D→E第①步反应________________。
B→A______________,D→E第①步反应________________。
(2)写出E、C的结构简式:E_______________。C_______________。
(3)C的一种同分异构体K有如下特点:1molK可以和3mol金属钠发生反应放出33.6LH2(标准状况下),1molK可以和足量的NaHCO3溶液反应,生成1molCO2,1molK还可以发生银镜反应生成2moIAg,试写出K的结构简式________________________。
(4)写出在浓硫酸存在并加热的条件下,F与足量乙醇反应的化学方程式
________________________________________________________________。
 31.(17分)影响绿色植物光合作用的因素是多方面的,既有内部因素(如酶的活性等),又有外界因素(如光照强度等),请根据下图回答有关问题:
31.(17分)影响绿色植物光合作用的因素是多方面的,既有内部因素(如酶的活性等),又有外界因素(如光照强度等),请根据下图回答有关问题:
(1)若x代表光照强度,反映光照强度影响光合速率的曲线是 ,其主要影响 阶段。
 (2)在外部因素适宜时,影响光合速率的内部因素除酶外,还有
,它对光合速率的影响有如下体现:
(2)在外部因素适宜时,影响光合速率的内部因素除酶外,还有
,它对光合速率的影响有如下体现:
①当光照强度影响光合速率达到最大值时,此时限制因素最可能是 。
②当CO2浓度影响光合速率达到最大值时,此时限制因素最可能是 。
(3)在不同季节或一天的不同时间,植物光合作用速率一般不同,图B是用来验证温度对光合速率影响的重要实验装置,请回答:
①本实验的原理是: 。
②在实验过程中可通过观察 来判断光合作用的强度。
③请用直角坐标图表示预期的实验结果。
29.(16分)某课外学习小组设计如下的简易实验装置,证明在相同条件下,体积相同、物质的量浓度也相同的两种强弱不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定该实验条件下的气体摩尔体积。请回答下列问题:
 ⑴请将该实验的
⑴请将该实验的 主要操作步骤补充完整:
主要操作步骤补充完整:
①配制浓度均为 1 mol·L-1的盐酸和醋酸溶液;
②用 量取10.00 mL 1 mol·L-1的盐酸和醋酸分别移入两个锥形瓶中;
③分别称取除去表面氧化膜的镁带 ag,并系于铜条末端,a的数值要大于 ;
④在广口瓶中装满水,按图连接好装置并检查装置的气密性;
⑤将铜条向下移动,使足量的镁带浸入酸中(铜条不与酸接触),至反应完全后,记录下 ;
⑥反应结束后,读取量筒中水的体积为V mL(包括导管中的水)。
⑵该实验中应该选用 规格的量筒。(填序号)
A. 100
mL
 B. 200
mL
C. 500 mL
B. 200
mL
C. 500 mL
⑶若不考虑水蒸气的影响,在该实验室条件下,气体摩尔体积的计算式为 。若仰视读取量筒内水的体积,则测得气体摩尔体积将 (填偏大、偏小或不变)。
28. (16分)A、B、C、D、E、F六种物质的相互转化关系如右图所示(反应条件未标出),其中反应①是置换反应。
(16分)A、B、C、D、E、F六种物质的相互转化关系如右图所示(反应条件未标出),其中反应①是置换反应。
(1)若A是常见的金属单质,D、F是气态单质,反应①在水溶液中进行,反应后溶液呈浅绿色。则反应②(在水溶液中进行)的离子方程式是 ;已知1 g D与F反应生成B时放出92.3 kJ热量,写出该反应的热化学方程式 。
(2)若B、C、F都是气态单质,且B有毒,③和④两个反应中都有水生成,反应②需要放电才能发生,A、D相遇有白烟生成,则A的分子构型为 ,C的结构式是 。
(3)若A、D为短周期元素单质,且所含元素的原子序数A是D的2倍,所含元素的原子核外最外层电子数D是A的2倍,③和④两个反应中都有红棕色气体生成,,反应④的化学方程式是 。
(4)若A、D、F都是非金属单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式是 。
27.(12分)A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充人A、B中,反应起始时,A、B的体积相同。
(已知:2NO2  N2O4;△H<0)
N2O4;△H<0)
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是VA_________VB (填“>”、“<”、“=”);若打开活塞K2,气球B将__________(填:变大、变小、不变)。
(2)若在A、B中再充人与初始量相等的NO2,则达到平衡时,A中NO2的转化率将_________ (填增大或减小、不变);若通人等量的Ne气,则达到平衡时,A中NO2的转化率将_________,B中NO2的转化率将_________(填:变大、变小、不变)。
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,_________中的颜色较深。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com