
17. (1)上表所列铜化合物中,铜的质量百分含量最高的是Cu2S
解释:CuFeS2:34.8% ;Cu5FeS4:63.5% ;Cu2S:80% ;CuCO3·Cu(OH)2:57.6%
(2) 反应的氧化剂是Cu2O,Cu2S
解释:Cu2O,Cu2S的Cu由+1被还原为0价,作氧化剂;Cu2S的S有-2价被氧化为+4价,作还原剂。
(3) SO2尾气直接排放到大气中造成环境污染的后果是形成酸雨。处理该尾气可得到有价值的化学品,写出其中1种酸和1种盐的名称硫酸,硫酸铵。
解释:处理SO2尾气一般为循环制备硫酸,和用Ca(OH)2或氨水吸收,可得到CaSO4和(NH4)2SO4等有价值的化学品。
(4) 简述粗铜电解得到精铜的原理:电解池中,粗铜作阳极,精铜作阴极,电解质为硫酸铜溶液。阳极上发生氧化反应,Cu失去电子,使Cu单质变为Cu2+进入溶液中Cu- e- == Cu2+;阴极上发生还原反应,Cu2+得到电子在阴极上析出Cu单质,Cu2++ e- == Cu,从而达到精制Cu的目的。
(5) A.D
解释:稀盐酸可以同Cu(OH)2与CuCO3反应,而且稀盐酸不能于Cu反应。所以稀盐酸可以除铜器表面的铜绿(CuCO3·Cu(OH)2),A正确。
铜表面不能形成致密氧化膜;铜和浓硫酸在常温下是反应的,生成硫酸铜、SO2和水,反应很慢,反应过程中放热,随着反应的进行,速率会越来越快的,所以不能用铜制容器装浓硫酸,B错误。
因为Fe比Cu活泼,所以Fe-Cu形成的原电池中,Fe作负极,更容易被氧化生绣,C错误。
蓝色硫酸铜晶体受热转化为白色硫酸铜粉末,只有旧键的断裂,没有新键的形成(CuSO4·5H2O中,H2O与Cu2+有配位键),故不属于化学变化,只有物理变化;CuSO4可用作消毒剂,但与前者没有因果关系,D正确。
综上所述,答案选AD。
0.250L×1.00mol·L-1-0.500L×0.100mol·L-1×2+0.0100L×1.00 mol·L-1=0.160mol

解得:x=0.0700mol y=0.0200mol
Na2CO3质量=0.0700mol×106g·mol-1=7.42g
NaHCO3质量=0.0200mol×84g·mol-1=1.68g
16、混合物中Na2SO4的质量= 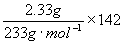 g·mol-1=1.42g
g·mol-1=1.42g
设混合物中Na2CO3和NaHCO3的物质的量分别为x和y,
反应中放出的CO2物质的量=
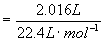 =0.0900mol
=0.0900mol
与Na2CO3、NaHCO3反应的盐酸的物质的量为:
15、 (1) 2Na2O2+2H2O=4NaOH+O2↑ Na2O+H2O=2NaO
(2) ⑤①④ (3) (G)接(A)(B)接(F)
{或 (1) 2Na2O2+2CO2=2Na2CO3+O2 Na2O+CO2=Na2CO3
(2) ⑤②⑥⑦①④ }
(3) (G)接 (D)(C) 接 (H)(I)[或(I)(H)] 接(J)(K) (或(K)(J)) 接(A)(B) 接(F)
14、 (1) Cu2++Fe====Cu+Fe2+ +2H++Fe=Fe2++H2↑
(2) 0.625m(或5/8)
13、 A:NaOH B:NaNO3 C:Ba(NO3)2 D:HNO3 X:MgSO4
11、B 12、B
1、B 2、D 3、A、D 4、A 5、A、C 6、B 7、B、C 8、C 9、A 10、A
18.由Fe2O3、Fe、CuO、C、Al中的几种物质组成的混合粉末,取样进行下列实验(部分产物略去):

(1)取少量溶液X,加入过量的NaOH溶液,有沉淀生成。取上层清液,通入CO2,无明显变化,说明样品中不含有的物质是(填化学式)________________。
(2)Z为一种或两种气体:
①若Z只为一种气体,试剂a为饱和NaHCO3溶液,则反应Ⅰ中能同时生成两种气体的化学方程式是______________________________。
②若Z为两种气体的混合物,试剂a为适量的水,则Z中两种气体的化学式是________________。
(3)向Y中通入过量的Cl2,并不断搅拌,充分反应后,溶液中的阳离子是(填写离子符号)________________。
(4)取Y中的溶液,调节pH约为7,加入淀粉KI和H2O2,溶液呈蓝色并有红褐色沉淀生成。当消耗2molI-时,共转移3mol电子,该反应的离子方程式是
(5)另取原样品,加入足量稀硫酸充分反应,若溶液中一定不会产生Y中的红色固体,则原样品中所有可能存在的物质组合是(各组合中物质用化学式表示)________________
第十二章 几种重要的金属第一课时 金属的概述
[例题解析] 例1.(B)例2. 解之,x=8∴A、B、C三种金属的相对原子质量分别是:24、40、56。 例3.解析:要根据每个反应的反应物间物质的量的关系,来判断符合哪个图象。
解:1、A 2、B 3、K 4、C,D 5、H 6、E 7、F 8、G 9、I 10、J 例4.A
例5. 答:该混和物中含K 3.9g, K2O 9.4g。
例6.生成Fe3+、Fe2+及原HNO3溶液的物质的量浓度分别为0.1mol/L、0.15mol/L和0.8mol/L。
例7. 解析与答案:
此题是2003年的高考题。源于教材,又高于教材,突出考查了运用基础知识和基本原理解决实验问题的能力。首先要抓住氢氧化亚铁的性质即易氧化,遇氧气迅速生成氢氧化铁。方法一是教材中的方法,为防止氧化,胶头滴管反常规操作,或在溶液中加入还原性物质如铁粉。方法二将原来的方法进行了改进,去掉了原有的胶头滴管,创设了新情境,要求考生在已经掌握制备氢氧化亚铁的实验操作及实验原理的基础上,说明方法二制备氢氧化亚铁的原理,同时也考查了对启普发生器的原理的理解。是考察逆向思维和创新精神的好题。具体答案如下:
方法一
(1)稀H2SO4 铁屑
(2)煮沸
(3)避免生成的Fe(OH)2沉淀接触O2
方法二
(1)稀H2SO4 铁屑
(2)NaOH溶液
(3)检验试管Ⅱ出口处排出的氢气的纯度。当排出的H2纯净时,再夹紧止水夹。
(4)试管I中反应生成的H2充满了试管I和试管Ⅱ,且外界空气不容易进入.
[针对训练]
17. 铜在自然界存在于多种矿石中,如:
|
矿石名称 |
黄铜矿 |
斑铜矿 |
辉铜矿 |
孔雀石 |
|
主要成分 |
CuFeS2 |
Cu5FeS4 |
Cu2S |
CuCO3·Cu(OH)2 |
请回答下列问题:
(1)上表所列铜化合物中,铜的质量百分含量最高的是 。
(2)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。该工艺的中间过程会发生反应:
2Cu2O+Cu2S  Cu+SO2↑,反应的氧化剂是 。
Cu+SO2↑,反应的氧化剂是 。
(3)SO2尾气直接排放到大气中造成环境污染的后果是 ;处理该尾气可得到有价值的化学品,写出其中1种酸和1种盐的名称 。
(4)黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制。请简述粗铜电解得到精铜的大批量: 。
(5)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是 (填字母)。
|
选项 |
陈述Ⅰ |
陈述Ⅱ |
判断 |
|
A |
铜绿的主成分是碱酸铜 |
可用稀盐酸除铜器表面的铜绿 |
Ⅰ对;Ⅱ 对;有 |
|
B |
铜表易形成致密的氧化膜 |
铜容器可以盛放浓硫酸 |
Ⅰ对;Ⅱ 对;有 |
|
C |
铁比铜活泼 |
例在铜板上的铁钉在潮湿空气中不易生锈 |
Ⅰ对;Ⅱ 对;有 |
|
D |
蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是物理变化 |
硫酸铜溶液可用作游泳池的消毒剂 |
Ⅰ错;Ⅱ 对;无 |
D.奥赛一瞥
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com