

20. (8分)银锌电池广泛用作各种电子仪器的电源,它的充放电过程可表示为:
2Ag+Zn(OH)2 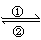
 Ag2O+Zn+H2O
Ag2O+Zn+H2O
回答下列有关问题:
(1)电池的放电过程是_____(填①或②)。
(2)该电池属于________性电池(填“酸”或“碱”或“中”)。
(3)反应①是________反应(填“放热”或“吸热”)。
(4)写出充电时的电极反应式:
阳极_______________________;阴极______________________。
(5)充电时,电池的正极应接电源的________极。
(6)简述回收该种废电池的意义________________________________________________
_________________________________________________________。
19. (6分)Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。
(1)该电池的负极材料是_________。电池工作时,电子流向______(填“正极”或“负极”)。
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀。其主要原因是______________________________________________________________。欲除去Cu2+,最好选用下列试剂中的___________(填代号)。
A.NaOH B.Zn C.Fe D.NH3·H2O
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。若电解电路中通过2mol电子,MnO2的理论产量是_______________。
18. 将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2,即可构成CH4燃料电池。已知通入CH4的一极,其电极反应式是:CH4+10OH--8e-= CO2- 3+7H2O;通入O2的另一极,其电极反应式是:O2+2H2O+4e-= 4OH-,该电池放电时,下列有关叙述中,不正确的是( )
A.通入CH4的电极为负极
B.正极发生氧化反应
C.燃料电池工作时溶液中的阴离子向负极移动
D.该电池使用一段时间后应补充KOH
第II卷:非选择题(共46分)
17. 下列说法正确的是( )
A.放热反应不一定是自发进行的反应
B.吸热反应一定是非自发进行的反应
C.自发进行的反应一定容易发生
D.反应速率快的反应一定是自发进行的
16. 在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
|
物质 |
X |
Y |
Z |
|
初始浓度/mol·L-1 |
0.1 |
0.2 |
0 |
|
平衡浓度/mol·L-1 |
0.05 |
0.05 |
0.1 |
下列说法错误的是( )
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y 2Z,其平衡常数为1600(mol·L-1)-2
2Z,其平衡常数为1600(mol·L-1)-2
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
15.
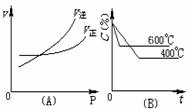 右图中C%表示某反应物在体系中的百分含量,v表示反应速度,P表示压强,t表示反应时间。图(A)为温度一定时压强与反应速度的关系曲线;图(B)为压强一定时,在不同时间C%与温度的关系曲线。同时符合以下两个图像的反应是( )
右图中C%表示某反应物在体系中的百分含量,v表示反应速度,P表示压强,t表示反应时间。图(A)为温度一定时压强与反应速度的关系曲线;图(B)为压强一定时,在不同时间C%与温度的关系曲线。同时符合以下两个图像的反应是( ) 
A.N2O3(g) NO2(g)+NO(g) DH>0
NO2(g)+NO(g) DH>0
B.4NH3(g)+5O2(g) 4NO(g)+6H2O(g)
DH<0
4NO(g)+6H2O(g)
DH<0
C.3NO2(g)+H2O(l) 2HNO3(l)+NO(g) DH<0
2HNO3(l)+NO(g) DH<0
D.CO2(g)+C(s) 2CO(g) DH>0
2CO(g) DH>0
14. 工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)=Si(s)+4HCl(g);△H=+QkJ·mol-1 (Q >0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl浓度为0.12 mol·L-1,则H2的反应速率为0.03mol·L-1·min-1
D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol·L-1的NaOH溶液恰好反应
13.
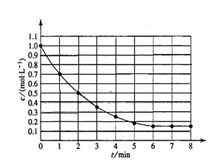 右图表示反应X(g)
右图表示反应X(g) 4Y(g)+Z(g),
4Y(g)+Z(g),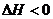 ,在某温度时X的浓度随时间变化的曲线:
,在某温度时X的浓度随时间变化的曲线:
下列有关该反应的描述正确的是( )
A.第6min后,反应就终止了
B.X的平衡转化率为85%
C.若升高温度,X的平衡转化率将大于85%
D.若降低温度,v(正)和v(逆)将以同样倍数减小
12.
两个体积相同的密闭容器A、B,在A中充入SO2和O2各1mol,在B中充入SO2和 O2各2 mol,加热到相同温度,有如下反应2SO2(g)+
O2(g)
O2各2 mol,加热到相同温度,有如下反应2SO2(g)+
O2(g) 2SO3(g),对此反应,下述
2SO3(g),对此反应,下述 不正确的是 ( )
不正确的是 ( )

A.反应速率B>A
B.SO2的转化率B>A 
C.平衡时各组分含量B = A D.平衡时容器的压强B>A
11.
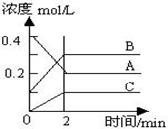 右图所示为8000C时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
右图所示为8000C时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
A.A是反应物 
B.前2 min A的分解速率 为0.1mol•L-1•min-1

C.达平衡后,若升高温度,平衡向正反应方向移动 
D.达平衡后,若增大压强,平衡向逆反应方向移动

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com