
9.有关我国太阳能的分布的叙述,正确的是 ( )
A.我国地处中纬度,大部分的地区阳光可以直射,太阳能资源丰富
B.我国东部的太阳能比西部丰富
C.太阳能最丰富的地区是海南岛
D.太阳能最贫乏的地区是四川盆地
2008年10月28日,太阳表面一个巨大的黑子群爆发,一股由太阳表面形成的巨大黑子群释放出来的气体和带电粒子流所引起的太阳“强风”,从当天晚上开始以每小时超过320万千米的速度直扑地球,太阳风暴对人类生活的影响,再次引起人们的关注。据此回答6-8题:
6.有关太阳活动的叙述,不正确的是( )
A.太阳黑子是太阳表面的低温区域
B.太阳“强风”的出现是太阳活动最激烈的显示
C.太阳黑子的多少与大小,可以作为太阳活动强弱的标志
D.太阳黑子与耀斑出现的周期相同
7.下列城市受此次太阳活动影响最大的是( )
A.满洲里 B.连云港 C.广州 D. 新加坡
8.太阳风暴对人类的影响不可信的是( )
A.对部分地区的短波通信和短波广播造成短时间影响
B.两极及高纬度地区出现极光
C.世界许多地区的降水量有异常的变化
D.地壳活动剧烈,火山、地震、泥石流频发
5.公元前28年(即汉成帝河平元年),曾记载“三月正未,日出黄,有黑气大如钱,居日中央”,这种现象发生在太阳大气层的( )
A.光球 B.色球 C.日冕 D.中心核
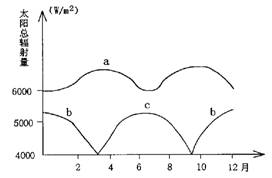
3.b、c可能位于( )
A.赤道附近 B.回归线附近
C.极圈附近 D.极地附近
4.a地可能分布在( )
A.冰岛 B.巴西 C.美国 D.新加坡
2.与地球上生命存在无关的因素是 ( )
A.地球的体积和质量适中
B.地球自西向东绕日公转
C.日地距离适中,地表温度适宜
D.地球附近大小行星各行其道,互不干扰
1.下列各组天体系统中均包含太阳和地球的是 ( )
A.太阳系、地月系 B.银河系、太阳系
C.河外星系、总星系 D. 地月系、总星系
24.
(8分)在一定温度下,将2mol
A和2molB 两种气体相混合于容积为2L的某密闭容器中,发生如下反应:3A(g)+B(g)  xC(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8mol
D,并测得C的浓度为0.4
mol·L-1,请填写下列空白:
xC(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8mol
D,并测得C的浓度为0.4
mol·L-1,请填写下列空白:
(1)x值等于________________;
(2)A的转化率为________;
(3)生成D的反应速率为____________;
(4)如果增大反应体系的压强,则平衡体系中C的质量分数________(增大、减小、不变)
 2009-2010学年度高二上学期教学质量调研
2009-2010学年度高二上学期教学质量调研
23.
(9分)在2L密闭容器内,800℃时反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
|
时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)(mol) |
0.020 |
0.01. |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K= 。
 已知:
已知: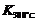 >
>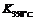 ,则该反应是 热反应。
,则该反应是 热反应。
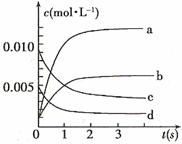
(2)右图中表示NO2的变化的曲线是 。
用O2表示从0~2 s内该反应的平均速率
v= 。
(3)能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
22. (8分)在一次学生实验中,学生用铝片分别和稀盐酸、稀硫酸反应,发现:铝片与稀盐酸反应现象非常明显,而和稀硫酸几乎不反应。这和教材中“铝能跟稀盐酸或稀硫酸反应生成氢气”的说法不一致。为排除因试剂变质等因素造成的影响,该学生在教师的指导下重新进行下列实验,验证是否存在上述现象。
实验用品:仪器(略,凡是实验需要的都有)
药品:3.0mol·L-1盐酸、1.5mol·L-1硫酸、3.0mol·L-1硫酸,相同大小的铝片(纯度>99.5%)
实验过程:往三根相同的试管中分别加入相同的铝片各一片,再往试管中分别加入等体积的3.0mol·L-1盐酸、1.5mol·L-1硫酸、3.0mol·L-1硫酸,观察反应进行到1、2、5、15、20分钟时的铝与酸反应的情况。结果如下:
|
反应进程(分钟) |
1 |
2 |
5 |
15 |
20 |
|
3.0mol·L-1盐酸 |
少量气泡 |
较多气泡 |
大量气泡 |
反应剧烈 |
铝片耗尽 |
|
1.5mol·L-1硫酸 |
均无明显现象(无气泡产生) |
||||
|
3.0mol·L-1硫酸 |
均无明显现象(无气泡产生) |
通过上述实验可知,无论是用1.5mol·L-1硫酸还是3.0mol·L-1硫酸,均无明显的现象,而3.0mol·L-1盐酸与铝片反应的现象却十分明显。
(1)写出铝与酸反应的离子方程式______________________________________________
(2)反应1--15min内,铝与盐酸的反应速率逐渐加快,其原因是____________________________________________________________________________________________________。
(3)根据以上探究“铝与稀盐酸和稀硫酸反应差异的原因”,你能对问题原因作出哪些假设或猜想(列出两种即可)?
假设一_____________________________________________________________
假设二______________________________________________________________
21. (7分)利用化学反应:2FeCl3 + Cu==2FeCl2 + CuCl2,选择适宜的材料和试剂,设计一个原电池。
可供选择的电极材料:铁棒、铜棒、石墨棒
可供选择的电解质溶液:CuCl2溶液、FeCl2溶液、FeCl3溶液
请填写下列空白:(1)选用 做正极材料, 做负极材料,选用 ___________做该原电池的电解质溶液。
(2)写出有关的电极反应式:正极: ;
负极: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com