
2. 已知抛物线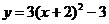 ,则其顶点坐标是( )
,则其顶点坐标是( )
A. 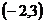 B.
B. 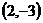 C.
C. 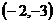 D.
D. 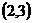
[下列各题的四个选项中,有且只有一个选项是正确的,选择正确项的代号并填涂在答题纸的相应位置上]
1. 下列各式从左到右的变形是正确的因式分解的是( )
A.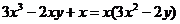 B.
B.
C.  D.
D.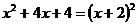
36.某课外活动小组在学习了铜与氧气反应(2Cu+O2=2CuO)这一性质后,想做一做“空气中氧气含量的测定”实验,并在最后将铜丝进行回收。
(1)课外活动小组对空气中氧气含量的测定做了如下实验:在由两个注射器组成的密闭系统内有50 mL空气,如右图。然后给装有铜丝的玻璃管加热。同时交替推动两个注射器的活塞,至玻璃管内的铜丝变黑且较长时间内无进一步变化时停止。停止加热后,待冷却至室温将气体全部推至一个注射器内。
请根据你对上述实验的理解,回答下列问题:
① 验结束后,注射器内空气的体积减少了约 mL,这是因为 。
②在实验的加热过程中,交替缓慢推动两个注射器的目的是 。
③上述实验只是粗略测定空气中氧气含量的一种方法,你认为造成该实验不够精确的
可能原因是 。
(2)课外活动小组发现红热的铜丝变黑后,为了回收再利用铜丝,在研究如何除去黑色
物质的讨论中,制定了下列方案。
请根据以上方案回答:
① 方案的烧杯中发生反应的化学方程式为
两种方案相比较,甲方案的不足之处是 。
②若采用甲、乙两种方案处理此变成黑色的铜丝,并且充分反应,则回收的铜丝a的质
量 (填“<”、“>”、“=”)铜丝b的质量。请通过分析和计算,采用甲、乙两种方案分别回收铜丝,所得到铜丝的质量理论上最多相差多少克?(提示:假设该实验中所取空气中氧气的密度为1.30 g/L。要求:计算结果精确到O.01 g。)
35、在通常状况下,氯气是一种黄绿色气体,密度比空气大,易溶于水。在工业上、实验
室中可以制取氯气,用来研究氯气的性质,并将其广泛应用于实际生产和生活中。
(1)在工业上,制取氯气的主要工艺流程如下:
①利用风吹日晒可以从海水中提取粗盐,该过程主要发生 (“物理”或“化学“)变化。
②要除去食盐水中混有的少量泥沙,可选择的操作方法是
③氯化钠溶液在通电条件下发生反应的化学方程式为
(2)在实验室中,可以用加热二氧化锰和浓盐酸来制取氯气,可采用右图装置制取氯气并测量产生Cl2的体积。
①能采用该气体发生装置的理由是
②该装置中油层的作用是 。
(3)氯气在常温下能分别与水、碱类等物质发生反应,并可以产生具有杀菌消毒、漂白(使有色物质褪色)等作用的物质。
①氯气与氢氧化钠溶液反应的化学议程式为:Cl2+NaOH=NaCl+NaClO+ H2O.氯气与石灰乳反应可抽取漂白粉,有关反应的方程式为:
②气与氢氧化钠溶液反应的化学方程式为:Cl2+ H2O=HCl+HClO。为了证明把氯气通入水的过程中,起漂白作用的物质是次氯酸(化学式为HClO),小明同学进行了如右图所示的探究实验。你认为小明设计的方案能够达到目的吗?若能,请说明理由。若不能,请补充实验帮助小明达到实验目的(写出实验步骤、现象及结论)。
(4)请计算:吸收14.2 g氯气,需要消耗20%的氢氧化钠溶液多少克?
34.根据右表“部分物质的溶解性表(20℃)所提供的信息,选用适量的试剂检验某氢氧化钠溶液中含有杂质硫酸钠和碳酸钠。
(1)请设计实验方案进行验证。(只要求写出所加试剂的化学式,以及分别产生的实验现象)
(2))请写出在上述验证过程中所发生反应的化学方程式(只要求写出其中一种方案即可)。
33.A是由植物发酵得到的一种有机燃料,请根据下列转化关系回答:
(1)若该有机燃料的化学式为CH3OH或C2H5OH。为了确定该有机物的成分,取一定量该无色液体A在空气中完全燃烧,生成8.8 g二氧化碳和7.2 g水。请判断该有机物应该是哪种物质?并简要说明判断理由。
(2)请按下列要求,写出上述关系图中有关反应的化学方程式。
①有气体生成的分解反应:
②有液体生成的置换反应:
③有两种氧化物生成的氧化反应:
32.人的胃液里含有适量的盐酸,可以帮助消化,但如果胃酸分泌过多,人会感到胃痛。小明拿来了两种抗酸药(治疗胃酸过多的药物)。,这两种药物说明书的部分内容如右图所示。 (1)请判断两种药品每片能消耗胃酸多少的关系是① ②。(填“大于”、“等于”或“小于”)
(2)患有胃溃疡(胃黏膜溃烂)的病人胃酸过多时,不宜服用含碳酸盐的抗酸药,其原因是
(3)嚼碎后服用可使药物与胃酸的反应速率加快,疗效快。现提供5%的稀盐酸和试管等仪器,请你设计实验方案,进行证明。
31.某化学研究小组在探究硫燃烧的实验时,设计了如右图所示的实验装置。
实验步骤:①将燃烧匙内的硫点燃后,立即伸入盛有空气的集气瓶内,并塞紧橡皮塞,观察现象。②将分液漏斗的活塞打开,同时打开胶皮管上的弹簧夹,观察现象。请回答下列问题:
(1)将注射器内的氧气推入集气瓶内后,发现硫燃烧更加剧烈,这种现象说明燃烧的剧烈程度与什么因素有关?
(2)分液漏斗内的氢氧化钠溶液、漏斗口的气球的作用分别是什么?
(3)写出探究过程中所发生反应的化学方程式。
30、在6月5日“世界环境日:活动中,某举小组对生产及生活汗水进行了探究。
(1)第一小组同学在学校附近的一家化工厂调查,发现该厂在生产过程中用到了硫酸。
[猜想]该工厂排放的废水呈酸性。
[设计实验]
|
实验操作 |
实验现象 |
实验结论 |
|
|
|
[建议与反思]为防止造成水污染,同学们联合向厂家建议,应将废水治理达标后再排放,你认为治理该酸性生废水时适宜加入的试剂是 (任答一种),此时废水的pH将 (填“升高”、“不变”或“降低”)。
[进一步探究]取一定体积从该厂排出的含硫酸的废水与一定量的氢氧化钠溶液混合后,溶液恰好呈中性。若改用跟该氢氧化钠溶液的质量和溶质质量分数均相同的氢氧化钾溶液与上述一定体积的废水混合,所得溶液的pH 7(填“<”、“>”、“=”)。
(2)另一小组同学在城市的一条小河中取了水样,发现水样浑浊,便在浑浊的水中加入适量的明矾,通过搅拌、静置后,发现水变得澄清了。
[查阅资料]明矾[化学式:KAl(SO4)2·12H2O]是一种常见的净水剂,它在水中解离出的离子主要有K+、Al3+、SO42+。
[提出问题]明矾中哪一种离子有净水作用?
[设计实验]小敏进行了如下实验,请填写表中空白:
[完善方案]小敏的实验方案不完善,需要对方案进行补充。请你将补充方案中的实验
目的和所使用的试剂填人下表:
29.汽车尾气中含有一氧化碳和一氧化氮,可以用高效催化剂在一定条件下将它们转化无害所体,反应的微观过程示意图如右图所示。请分别从物质的组成、物质(或分子)的构成及变化或其他方面写出你所获得的有关信息(任答三条)。
组成或构成变化其他
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com