
12. 常温下,下列各组数据中比值为2:1的是 A.电解熔融氯化钠,在阴极和阳极上析出产物的物质的量之比 B.中和体积相同、pH相同的硫酸和盐酸消耗NaOH的物质的量之比 C.1 mol·L-1氨水溶液与0.5 mol·L-1氨水溶液中c(OH-)之比 D.物质的量相同的水和乙酸与足量金属钠反应产生氢气的体积之比
11.下列叙述中,错误的是 A.虽然固体氯化钠不能导电,但氯化钠是电解质
B.纯水的pH随温度的升高而减小 C.在醋酸钠溶液中加入少量氢氧化钠,溶液中c(OH-)增大 D.在纯水中加入少量硫酸铵,可抑制水的电离
10.下列说法错误的是
A.对于反应C(s)+ CO2
(g) =2CO(g) △H >0 ,升高温度会加快化学反应速率
B.合成氨反应中,当3v(NH3)正=2v(H2)逆时,反应达到平衡
C.将nmol H2(g)、n mol I2(g)和2n mol H2 (g)、2n mol I2(g)分别充入两个恒温恒容的容器中,平衡时H2的转化率前者小于后者
D.对于反应PCl5(g) PCl3(g)+Cl2(g),达到平衡后,若保持温度容积不变,又加入一定量的PCl5,则该平衡向正方向移动,但平衡时PCl5的转化率减小
PCl3(g)+Cl2(g),达到平衡后,若保持温度容积不变,又加入一定量的PCl5,则该平衡向正方向移动,但平衡时PCl5的转化率减小
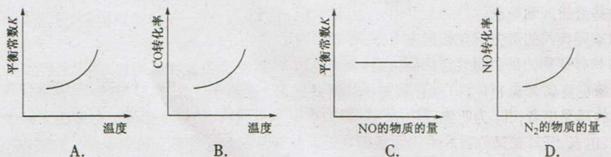
9.汽车尾气净化中的一个反应如下:
NO(g)+CO(g)  1/2N2(g)+CO2(g) ⊿H=-373.4kJ/mol
1/2N2(g)+CO2(g) ⊿H=-373.4kJ/mol
在恒容密闭容器中,反应达平衡后,改变某一条件,下列示意图正确的是
8.
 一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如右图所示。有关
一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如右图所示。有关
a、b、c三点的下列说法中正确的是
A.醋酸的电离程度由大到小的顺序:b>c>a
B.溶液的pH由大到小的顺序: a>c>b
C.用湿润的pH试纸测量醋酸溶液的pH,测量结果均偏大
D.与等浓度NaOH溶液中和,消耗NaOH溶液的体积b最多
7.T°C时,将体积为VAL、浓度为a mol/L的一元酸HA与体积为VBL、浓度为b mol/L的一元碱BOH混合,混合液恰好呈中性,则下列判断正确的是 ( )
A.混合液的pH=7 B.a=b C.混合液中Kw=[c(H+)]2 D.a=b,VA=VB
6.在amL浓度为c mol·L-1的AgNO3溶液中加入一定体积的pH=1的盐酸时,恰好使溶液中Ag+完全沉淀,此时得到pH=2的溶液100 mL(设反应前后溶液体积变化忽略不计),则c的值是( )
A.0.0020 B.0.011 C.0.11 D.0.22
5.燃料电池是燃料(例如CO,H2,CH4等)跟氧气或空气起反应,将此反应的化学能转变为电能的装置,电解质通常是KOH溶液。下列关于甲烷燃料电池的说法不正确的是 ( )
A.负极反应式为CH4+10OH--8e=CO32-+7H2O
B.正极反应式为O2+2H2O+4e=4OH-
C.随着不断放电,电解质溶液碱性不变
D.甲烷燃料电池的能量利用率比甲烷燃烧的能量利用率大
4.下列溶液中有关微粒的物质的量浓度的比较正确的是 ( )
A.常温下两种溶液①0.1mol/L CH3COOH溶液 ②0.3mol/L CH3COOH溶液与0.1mol/LNaOH溶液等体积的混合液, c(H+):①<②
B.常温下将NaHCO3与NaHSO3混合溶于水,恰好呈中性的溶液中:
c(Na+)= c(HCO3-)+c(HSO3-)+2c(CO32-)+2c(SO32-)
C.相同条件下,pH=9的①CH3COONa溶液、②NH3·H2O溶液、③NaOH溶液中,由水电离出的
c(OH-):①>②>③
D.已知酸性HF>CH3COOH,物质的量浓度相等的NaF与CH3COOK溶液中:
[c(Na+)-c(F-)] >[c(K+)-c(CH3COO-)]
3.下列实验事实不能证明醋酸是弱酸的是 ( )
A.常温下,测得醋酸钠溶液的pH>7
B.常温下,测得0.1mol/L醋酸溶液的pH=4
C.常温下,将pH=1的醋酸溶液稀释1000倍,测得pH<4
D.常温下,将物质的量浓度相同的醋酸溶液与氢氧化钠溶液等体积混合后恰好中和
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com