
15.正电子发射型计算机断层显像(PET)的基本原理是:将放射性同位素 O注入人体,
O注入人体, O在人体内衰变放出的正电子与人体内的负电子相遇湮灭转化为一对
O在人体内衰变放出的正电子与人体内的负电子相遇湮灭转化为一对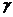 光子,被探测器采集后,经计算机处理生成清晰图象.则根据PET原理判断下列表述不正确的是
光子,被探测器采集后,经计算机处理生成清晰图象.则根据PET原理判断下列表述不正确的是
A. O在人体内衰变方程是
O在人体内衰变方程是 O→
O→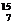 N+
N+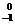 e
e
B.正、负电子湮灭方程是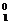 e +
e +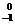 e→2
e→2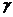
C.在PET中, O主要用途是作为示踪原子
O主要用途是作为示踪原子
D.在PET中, O主要用途是参与人体的新陈代谢
O主要用途是参与人体的新陈代谢
14. 华裔科学家高锟获得2009年诺贝尔物理奖,他被誉为“光纤通讯之父”。
光纤通讯中信号传播的主要载体是光导纤维,它的结构如图所示,其内芯和外套材料不同,光在内芯中传播。下列关于光导纤维的说法中正确的是
华裔科学家高锟获得2009年诺贝尔物理奖,他被誉为“光纤通讯之父”。
光纤通讯中信号传播的主要载体是光导纤维,它的结构如图所示,其内芯和外套材料不同,光在内芯中传播。下列关于光导纤维的说法中正确的是
A.内芯的折射率比外套的大,光传播时在内芯与外套的界面上发生全反射
B.内芯的折射率比外套的小,光传播时在内芯与外套的界面上发生全反射
C.波长越短的光在光纤中传播的速度越大
D.频率越大的光在光纤中传播的速度越大
33.(8分)[化学-有机化学基础]
达菲是治疗甲型H1N1流感的特效药,它是由我国中药材“八角”(大茴香)的提取物--莽草酸为原料合成的。已知莽草酸和达菲的结构式如下:
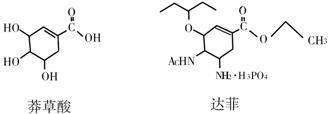
(1)写出莽草酸中含氧官能团的名称 。
(2)有机物A是合成达菲的中间体:
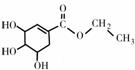
①写出由莽草酸合成A的化学方程式 。
该反应属于 反应(填反应类型)。
②中间体A有多种同分异构体,其中符合下列结构通式的同分异构体(除A外)有 种。
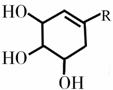 R为含
R为含 的基团
的基团
32.(8分)[化学-物质结构与性质]
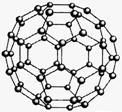 C60(结构模型如下图所示)的发现是化学界的大事之一。C60 与金属钾化合生成K3C60?。K3C60具有超导性。
C60(结构模型如下图所示)的发现是化学界的大事之一。C60 与金属钾化合生成K3C60?。K3C60具有超导性。
(1)碳原子的价电子排布式为 。
(2)C60分子中的杂化轨道介于石墨和金刚石的杂化轨道之间,则石墨和金刚石中碳原子的杂化方式分别是 、 。
(3)K3C60属于离子晶体,其中阴阳离子个数比为1∶3,则该晶体的构成微粒为 。(用化学式表示)
(4)已知C60晶体内相邻C60球体间的距离是304pm,与石墨平面层间距离(335pm)相比较,说明C60晶体中C60和C60间作用力属于 (填“离子键”、“共价键”或“分子间作用力”),两者数据存在差异的原因是 。
31.(8分)[化学-化学与技术]
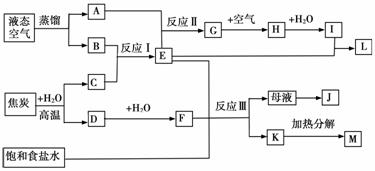 下图表示某些化工生产的流程(有的反应条件和产物已略去)
下图表示某些化工生产的流程(有的反应条件和产物已略去)
请回答下列问题:
(1)流程中所涉及的化学工业 (写出两个即可)。
(2)反应I需在500℃进行,主要原因是 ;实际工业生产中,反应Ⅱ的条件是 。
(3)工业上,析出K后,再向母液中继续通入E,并加入细小食盐颗料,其目的是 。
30.(16分)下表是实验室制备气体的有关内容:
|
编号 |
实验内容 |
实验原理 |
气体发生装置 |
|
① |
制氧气 |
H2O2→O2 |
|
|
② |
制氨气 |
NH4Cl→NH3 |
|
|
③ |
制氯气 |
HCl→Cl2 |
|
(1)上述气体中:从制备过程看,必须选择合适的氧化剂才能实现的是 (填气体的化学式。下同。);从反应原理看,明显不同于其他两种气体的是 。
(2)根据表中所列实验原理,从下列装置中选择合适的气体发生装置,将其编号填入上表中的空格中。

(3)若用上述制备O2的装置制备NH3,则选择的试剂为 。
(4)制备Cl2需用8 mol·L-1的盐酸100mL,现用12 mol·L-1的盐酸来配制。
①为提高配制的精确度,量取浓盐酸的仪器可选用下列的 (填序号)
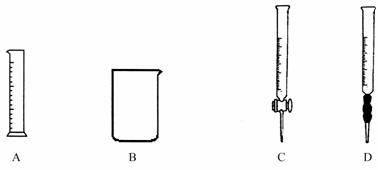
②配制过程中,除上图所列仪器外,还需要的仪器有 、 、
。
③若标定所配盐酸的浓度是否准确,常采用的实验方法名称是 。
(5)若用排空气法收集Cl2,请气体收集装置图。
[选做部分]
共8个题,考生从中选择2个物理题、1个化学题和1个生物题作答。
29.(14分)据报道, 有一种叫Thibacillus Ferroxidans的细菌在氧气存在下,酸性溶液中,将黄铜矿氧化成硫酸盐:
4CuFeS2 + 2H2SO4 + 17O2 = 4CuSO4 + 2Fe2(SO4)3 + 2H2O
(1)利用反应后的溶液,按如下流程可制备胆矾(CuSO4·5H2O):
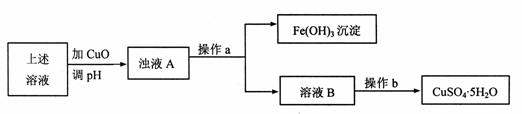
①溶液B显 (填“酸”、“碱”或“中”)性,原因是 (用离子方程式表示)。
②分析下表所提供的数据可知,加入CuO可除去CuSO4溶液中的Fe3+。
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe3+ Cu2+ |
1.9 4.7 |
3.2 6.7 |
请运用沉淀溶解平衡的有关理论解释加入CuO能除去CuSO4溶液中Fe3+的原因:
③操作a的名称是 ,操作b的操作方法是 。
④检验溶液B中Fe3+是否被除尽的试剂是 ,证明Fe3+已被除尽的现象是 。
(2)在实验室中,设计两个原理不同的方案,从溶液B中提炼金属铜(要求:一种方案只用一个反应来完成)。写出两种方案的化学方程式:
方案一:
方案二:
28.(12分)我国在青藏高原发现了名为“可燃冰”的环保型新能源。
(1)“可燃冰”属于化石燃料,主要成分是CH4。另外还有两种化石燃料,它们的名称分别是 和 。
(2)CH4可与Cl2反应,反应历程如下
①Cl-Cl→2Cl· ΔH= 243 kJ·mol-1
②Cl·+CH3-H→·CH3+H-Cl ΔH= 4 kJ·mol-1
③CH3+Cl-Cl→CH3--Cl+Cl· ΔH= -106 kJ·mol-1
则CH4与Cl2反应生成CH3-Cl(g)的热化学方程式为 。
(3)CH4可用于设计燃料电池,甲烷燃料电池的工作原理如下图所示:
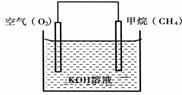
则通入CH4的一极为原电池的 (填“正极”或“负极”),正极的电极反应式为 。
(4)CH4与H2O在隔绝空气、高温和催化剂条件下反应:
 CH4(g)+H2O(g)
CH4(g)+H2O(g)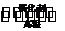 CO(g)+3H2(g) ΔH=m
kJ·mol-1?
CO(g)+3H2(g) ΔH=m
kJ·mol-1?
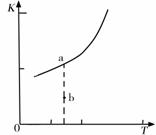
则反应的平衡常数表达式K= ,
K的 大小与温度(T)的关系如右图中曲线所示,
则m 0(填“>”“=”或“<”=;改变某一条
件,使状态从a点到达b点,若保持温度不变,反
应再次达到平衡时,则CH4的转化率
(填“增大”、“减小”、“不变”或“不确定”),反应的焓
变(△H)将 (填“增大”、“减小”或
“不变”)。
15.已知,2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O
MnO2+4HCl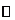 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
其中,KMnO4和一般浓度的盐酸反应,K2Cr2O7需和较浓的盐酸(﹥6 mol·L-1)反应,MnO2需和浓盐酸(﹥8 mol·L-1)反应。
以下结论中,不正确的是 ( )
A.上述反应既属于氧化还原反应,又属于离子反应
B.生成1 mol Cl2转移电子数均为2 NA(NA为阿伏加德罗常数)
C.氧化性:KMnO4﹥K2Cr2O7﹥Cl2﹥MnO2
D.盐酸的浓度越大,Cl-的还原性越强
14.CaCO3溶于盐酸生成CO2:CaCO3+2HCl=CaCl2+ CO2↑+H2O。则下列说法中,正确的是
( )
A. 该反应的离子方程式为?CO32-+2H+=CO2↑+H2O
B.与同浓度的盐酸反应,块状大理石的反应速率比粉末状的大
C.CaCO3溶于盐酸是因为H+ 破坏了CaCO3的沉淀溶解平衡,使其Ksp增大
D.CaCO3与适量的盐酸恰好完全反应所得溶液中
c (H+)=c (OH-)+2c (CO32-)+c (HCO3-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com