
14. Na2CO3·10H2O和 NaHCO3的混合物n g,溶于水配制成200 mL溶液,测得c(Na+)=0.5 mol/L。若将n g该混合物加热至质量不再改变时,得到的固体质量为
A.3.l g B.5.3 g C.9.0 g D.11.0 g
13. 室温下,下列各组物质不能用一种试剂通过化学反应区别的是
A.MnO2 CuO FeO B.(NH4)2SO4 K2SO4 NH4Cl
C.AgNO3 KNO3 Na2CO3 D.Na2CO3 NaHCO3 K2CO3
12. 已知:KClO3 + 6HCl(浓) = KCl + 3Cl2↑ + 3H2O。如图3所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用较大的表面皿盖好。下表中由实验现象得出的结论完全正确的是
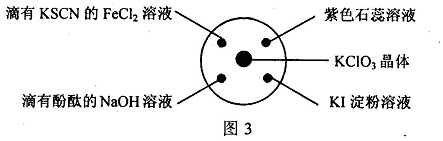
|
选项 |
实验现象 |
结论 |
|
A |
滴有KSCN的FeCl2溶液变红 |
Cl2具有还原性 |
|
B |
滴有酚酞的NaOH溶液褪色 |
Cl2具有酸性 |
|
C |
紫色石蕊溶液先变红后褪色 |
Cl2具有漂白性 |
|
D |
KI淀粉溶液变蓝色 |
Cl2具有氧化性 |
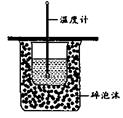
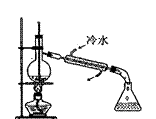
11. 图所示为实验室中完成不同的化学实验所选用的装置或进行的操作,其中没有明显错误的是
|
测定中和热 |
用石灰石和稀 盐酸制取CO2 |
蒸馏石油 |
配制溶液中
|
||
|

10. 下列说法可以实现的是
①酸性氧化物均能与碱发生反应,②弱酸盐溶液与酸反应可以生成强酸,③发生复分解反应,但产物既没有水生成,也没有沉淀和气体生成,④两种酸溶液充分反应后,所得溶液呈中性,⑤有单质参加反应,但该反应不是氧化还原反应
 A.②③④ B.②③⑤ C.①②④ D.①②③④⑤
A.②③④ B.②③⑤ C.①②④ D.①②③④⑤
9. 某无色溶液中可能含有①Na+ 、②Ba2 +、
③Cl一、 ④Br–一、⑤SO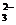 、⑥SO
、⑥SO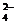 离子中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下。
离子中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下。
|
步骤 |
操作 |
现象 |
|
(1) |
用pH试纸检验 |
溶液的pH大于7 |
|
(2) |
向溶液中滴加氯水,再加入CCl4振荡,静置 |
CCl4层呈橙色 |
|
(3) |
向所得水溶液中加入Ba(NO3)2溶液和稀HNO3 |
有白色沉淀产生 |
|
(4) |
过滤,向滤液中加入AgNO3溶液和稀HNO3 |
有白色沉淀产生 |
下列结论正确的是
A.肯定含有的离子是①④⑤ B.肯定没有的离子是②⑥
C.不能确定的离子是① D.不能确定的离子是③⑤
8. 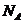 表示阿伏加德罗常数,下列说法正确的是
表示阿伏加德罗常数,下列说法正确的是
A.标准状况下,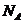 个SO3分子所占的体积约为22.4 L
个SO3分子所占的体积约为22.4 L
B.铁粉与一定量的浓硫酸反应,若产生11.2 L SO2和1 g H2,铁粉失去的电子数为2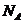
C.60g SiO2晶体中含硅氧键为4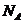 个
个
D.1molNaHSO4晶体中含有的离子总数为3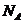
7. 氯气与碘在加热条件下按一定比例反应可以得到一种红棕色液体ICl(氯化碘),ICl的性质类似于卤素,有很强的化学活动性。
例如:ICl + H2O = HCl + HIO,2Zn + 2ICl = ZnCl2 + ZnI2 ,下列叙述正确的是
A.在Zn跟ICl的反应中,ZnI2既是氧化产物又是还原产物
B.在H2O跟ICl的反应中,ICl是氧化剂,H2O是还原剂
C.在Zn跟ICl的反应中,ZnCl2既是氧化产物又是还原产物
D.在H2O跟ICl的反应中,ICl既是氧化剂又是还原剂
6. 现有甲乙两瓶相同体积的硫酸溶液,甲的质量分数为0.98、物质的量浓度为c1,乙的质量分数为0.14,物质的量浓度为c2;下列有关这两瓶溶液的说法中,正确的是
A.将两瓶溶液完全混合后,所得溶液的质量分数为0.56
B.分别等质量的NaOH溶液反应,甲放出的热量多
C.分别与适量的锌粒反应,可以用同一离子方程式表示
D.c1=7 c2
5. 下列离子方程式正确的是
A.用惰性电极电解饱和氯化镁溶液:2Cl- + 2H2O H2↑+
Cl2↑+2OH-
H2↑+
Cl2↑+2OH-
B.用银氨溶液检验乙醛中的醛基:
CH3CHO +2Ag(NH3)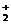 +
2OH-
+
2OH- CH3COONH4
+3NH3 + 2Ag↓+ H2O
CH3COONH4
+3NH3 + 2Ag↓+ H2O
 C.苯酚钠溶液中通入少量CO2:CO2 + H2O + 2C6H5O-
C.苯酚钠溶液中通入少量CO2:CO2 + H2O + 2C6H5O- 2C6H5OH + 2 CO
2C6H5OH + 2 CO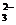
D.少量的Na2SO3溶液使酸性KMnO4溶液褪色:
5 SO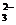 + 6H+ + 2MnO
+ 6H+ + 2MnO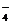 == 5 SO
== 5 SO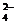 + 2Mn2+ +3H2O
+ 2Mn2+ +3H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com