
4. 常温下将10mL PH=13的Ba(OH)2溶液加水稀释至100mL,所得溶液的PH为
A. 14 B. 12.7 C. 12 D. 10
3. 将0.lmol·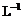 醋酸溶液加水稀释,下列说法正确的是
醋酸溶液加水稀释,下列说法正确的是
A.溶液中c(H+)和c(OH-)都减小 B.溶液中c(H+)增大
C.醋酸电离平衡向左移动 D.溶液的pH增大
2. 下列物质的水溶液能导电,但属于非电解质的是
A.CH3COOH B.Cl2 C.NH4NO3 D.CO2
1. 氨水中所含有的分子和离子有
①NH4+ ②H2O ③NH3 ④NH3·H2O ⑤H+ ⑥OH-
A.①②③ B.②③④⑤ C.②③④⑤⑥ D.①②③④⑤⑥
下列框图中的A-G是中学化学中常见的七种物质,所有物质均由短周期元素组成,已知常温、常压下D为无色液体,B、C、E为单质,其中C、E为气体,B为金属。A-G可发生如下转化:
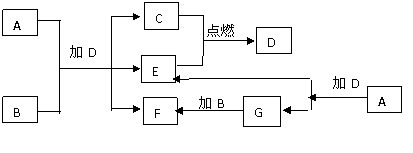
请填写下列空白:
(1)D的结构式为 ,G的电子式为 。
(2)5.4gB与G溶液完全反应,转移的电子的物质的量为 。
(3)向F的水溶液中通入足量的CO2气体,其离子方程式为
。
(4)8g单质C完全燃烧生成气态D,放出967.2kJ的热量,该反应的热化学方程式为 。
①A与B 反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失。
②B与C 反应生成白色沉淀E和气体H;
③C与D 反应生成有色沉淀F和气体H。
(1)分别写出它们的化学式:
A B C D
E F H
(2)写出①中再加过量A沉淀量减少的离子方程式:
(3) 胶体F也是一种常用的化学物质,写出制备胶体F的离子方程式: ;
如果用胶体F做电泳实验, 极附近颜色加深
1L某混合溶液,可能含有的离子如下表:
|
可能大量含有的阳离子 |
H+、K+、Mg2+、Al3+、NH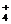 、Fe2+、Fe3+ 、Fe2+、Fe3+ |
|
可能大量含有的阴离子 |
Cl-、Br-、I-、CO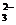 、AlO 、AlO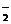 |
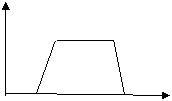 (1)往该溶液中逐滴加入NaOH溶液, n
(1)往该溶液中逐滴加入NaOH溶液, n
产生沉淀的物质的量(n)与加入NaOH溶液 b c
的体积(V)的关系如下图所示。则该溶液中
确定含有的离子是________________, O a d V
一定不含有的阳离子是 ,一定不存在的阴离子是 ,
b→c 的离子方程式为 。
(2)经检测,该溶液中还含有大量的Cl-、Br-、I-,若向1 L该混合溶液中通入一定量的Cl2 ,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
|
Cl2的体积(标准状况) |
2.8 L |
5.6 L |
11.2 L |
|
n(Cl-) |
1.25 mol |
1.5 mol |
2 mol |
|
n(Br-) |
1.5 mol |
1.4 mol |
0.9 mol |
|
n(I-) |
a mol |
0 |
0 |
当通入Cl2 的体积为2.8 L时,溶液中发生反应的离子方程式为
______ ______。
②原溶液中Cl-、Br-、I-的物质的量浓度之比为__________________。
(1)实验室要配制1mol/L的稀硫酸250mL,回答下列问题:
① 需要98%密度为1.84g/cm3的浓硫酸 mL。
② 配制时,必须使用的仪器除 20 mL量筒, 250 mL容量瓶,玻璃棒外,还需要的玻璃仪器有 。
③ 配制时,该实验两次用到玻璃棒,其作用分别是 、 。
 ④ 配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”、“偏低”或“不影响”)没有洗涤烧杯和玻璃棒 ;容量瓶没有干燥 。
④ 配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”、“偏低”或“不影响”)没有洗涤烧杯和玻璃棒 ;容量瓶没有干燥 。
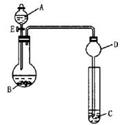 (2)用如右图所示装置(夹持仪器省略,暂不考虑尾气的吸收)进行实验,将液体A逐滴加入到固体B中,回答下列问题:
(2)用如右图所示装置(夹持仪器省略,暂不考虑尾气的吸收)进行实验,将液体A逐滴加入到固体B中,回答下列问题:
① 如何检验该装置的气密性
② 若A为30% H2O2溶液,B为MnO2,C盛有氢硫酸(H2S)
饱和溶液,旋开E后,C中的现象为_______________;
B中发生反应的化学方程式为_____________ 。
③ 若A为浓盐酸,B为KMnO4,C中盛有KI淀粉溶液,
旋开E后,C中的现象是___________________ ;
B中发生反应的离子方程式为_________________ 。
④ 图中D装置在实验中的作用是__________________________。
16.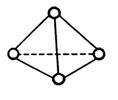 化学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如右图所示),与白磷分子相似。已知断裂1 mol N-N键吸收193 kJ热量,断裂1 mol N≡N键吸收941 kJ热量,则
化学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如右图所示),与白磷分子相似。已知断裂1 mol N-N键吸收193 kJ热量,断裂1 mol N≡N键吸收941 kJ热量,则
A.相同条件下,N4比N2更稳定
B.1 mol N4气体转化为N2时要吸收748 kJ能量
C.N4的熔点比P4高
D.1 mol N4气体转化为N2时要放出724kJ能量
15. F2和Xe在一定条件下可生成氧化性极强且极易水解的XeF2、XeF4和XeF6三种化合物。如XeF4与水可发生如下反应:
6XeF4 + 12H2O == 2XeO3 + 4Xe↑+ 24HF + 3O2↑。下列判断中正确的是
A.XeF2分子中各原子均达到8电子稳定结构
B.XeF6分子中Xe的化合价为+6价
C.上述反应中氧化剂和还原剂的物质的量之比为2∶3
D.XeF4按上述方式水解,每生成4 mol Xe,转移12 mol电子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com