
5. 如图所示,两个质量相同的物体1和2,紧靠在一起放在光滑的水平面上,如果它们分别受到水平推力F1和F2的作用,而且F1>F2,则1施于2的作用力的大小为( )
A.F1 B.F2
C.(F1+F2)/2 D.(F1-F2)/2
4.如图所示,将一个质量为m的物体,放于固定在台秤盘上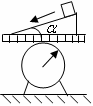
 的一个倾角为
的一个倾角为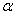 的光滑斜面上,则物体下滑过程中,台秤
的光滑斜面上,则物体下滑过程中,台秤
的示数与未放m时比较将( )
A.增加mg B.减少mg
C.增加mgcos2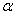 D.减少mg2(1+sin2
D.减少mg2(1+sin2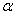 )
)
3.石丽同学在由静止开始向上运动的电梯里,将一测量加速度的小探头固定在质量为1 ㎏的手提包上,到达某一楼层停止,采集数据并分析处理后列表如下:(g取9.8m/s2)
|
运动规律 |
匀加速直线运动 |
匀速直线运动 |
匀减速直线运动 |
|
时间段(s) |
0-2.5 |
2.5-11.5 |
11.5-14.0 |
|
加速度(m/s2) |
0.40 |
0 |
0.40 |
石丽同学在计算机上绘出如下图象,设F为手对提包的拉力.请你判断下图中正确的是 ( )
2.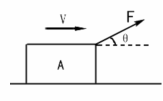 如右图所示,水平地面上的物体A,在斜向上的拉力F作用下,向右做匀速直线运动,
如右图所示,水平地面上的物体A,在斜向上的拉力F作用下,向右做匀速直线运动,
则下列说法中正确的是( )
A、物体A一定受到五个力作用
B、物体A一定受到三个力作用
C、物体A受到的滑动摩擦力的大小为Fcosθ
D、水平地面对A的支持力的大小为Fsinθ
1. 如图所示,木块A在斜面B上匀速下滑时,B相对地面静止,则B受到地面的摩擦力( )
A.无 B.有,向左 C.有,向右 D.有,方向无法确定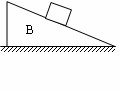
29.(8)铜和浓硝酸反应生成NO2,当浓硝酸变稀后,则生成NO,3.84克铜和适量浓硝酸反应后,铜全部反应完,收集到标准状况下NO和NO2混合气体共2.24L,求:
(1)参与反应的HNO3的物质的量。
(2)生成的混合气体中NO的体积。
28.(10)实验室制取SO2的反应原理为:
Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:
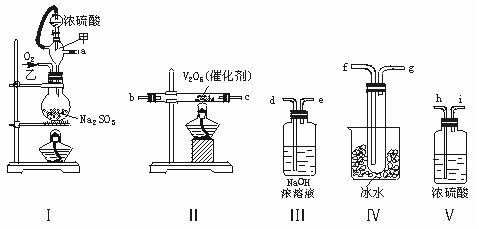
(1)这些装置的连接顺序(按气体左右的方向)是 → → → →
→ → → (填各接口的编号)。
(2)实验时甲仪器的作用与原理是 。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是 。
(4)Ⅳ处观察到的现象是 。
(5)在Ⅰ处用大火加热烧瓶时,SO2的转化率会 (填“增大”“不变”或“减小”)。
(6)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得 III 处增重m g,则本实验中SO2的转化率为 。
27、(10)在一定条件下进行下列化学反应,请根据以下的转化关系回答下列问题,已知A、B、C中均含有同一种元素。
(1)已知:
 , D为非金属单质。
①若A为非金属单质,则C可能为(回答二种,下同) ;
②若A为某无机气态化合物,则A可能为
;
, D为非金属单质。
①若A为非金属单质,则C可能为(回答二种,下同) ;
②若A为某无机气态化合物,则A可能为
;
(2)已知:  ①若D为金属单质,且以上反应均为氧化还原反应,请写出检验B中阳离子的二种方法
;
②若D为碱,且以上反应均为非氧化还原反应,则A、B、C、D分别可以是:(按顺序写出合理的一组物质的化学式即可)A
,B
,C
,D
。
三、实验题
①若D为金属单质,且以上反应均为氧化还原反应,请写出检验B中阳离子的二种方法
;
②若D为碱,且以上反应均为非氧化还原反应,则A、B、C、D分别可以是:(按顺序写出合理的一组物质的化学式即可)A
,B
,C
,D
。
三、实验题
26、(10分)有W、X、Y、Z四种原子序数依次增大的元素。已知:
①W与X或Y形成的化合物的焰色反应均呈黄色;
②X原子次外层电子数为核外电子总数的一半;
③X离子、Y离子均与Y的气态氢化物具有相同电子数;
④Z可与Y组成化合物ZY2和ZY3;
请回答:
(1)Z元素在元素周期表中的位置是第 周期 族
(2)W2X的电子式为 ,其水溶液呈碱性的原因是(用离子方程式表示)
。
(3)写出由化合物ZY2溶液制得ZY3溶液的离子方程式:
。
当有0.1mol电子转移时,生成ZY3的物质的量是 。
(4)将ZY3 饱和溶液滴入沸水可得到红褐色液体,此液体具有的性质是
a.光束通过该液体时,形成光亮的通道
b.插入电极通直流电,阳极附近液体颜色加深
c.将该液体加热、蒸干并灼烧后,有红棕色物质生成
d.该液体中分散质粒子可以透过半透膜
(5)Z的二价氢氧化物在制备时的注意事项
变质时的现象
写出在制备Z的二价氢氧化物时其变质的化学方程式
25、(10分)有一种溶液,其中含有Ag+、Al3+、K+、Mg2+。
(1)向溶液中加入足量的氯化钠溶液,现象为 。
反应的离子方程式 。
(2)将实验(1)所得溶液过滤,向滤液中滴加过量氢氧化钠溶液,现象为
溶液中进行的反应的离子方程式 、 、
。
(3)将实验所得的溶液过滤,向滤液中滴加过量的盐酸,产生的现象为
溶液中进行的反应的离子方程式 、 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com