
6. 膜技术原理在化工生产中有着广泛的应用。有人设想利用电化学原理制备少量硫酸和绿色硝化剂N2O5,装置图如下。
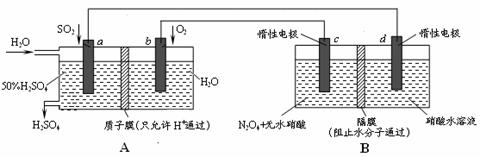
⑴A装置是________,B装置是_________(填“原电池”或“电解池”)。
⑵N2O5在电解池的______区生成,其电极反应式为_____________________________。
⑶通入O2一极的电极反应式为_______________________________。
⑷若通入SO2的速率为2.24 L·min-1(标准状况),为稳定持续生产,硫酸溶液的浓度应维持不变,则左侧水的流入速率应为_________mL·min-1。
5.
下图Ⅰ、Ⅱ分别是甲、乙两组同学将反应“AsO43 -+2I-+2H+ AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液。
AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液。
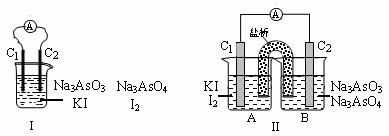
下列叙述中正确的是
A.甲组操作时,微安表(A)指针发生偏转
B.甲组操作时,溶液颜色变浅
C.乙组操作时,C2作正极
D.乙组操作时,C1上发生的电极反应为I2 +2e- 2I-
2I-
4. 下列四种装置中,溶液的体积均为250 mL,开始时电解质溶液的浓度均为0.10 mol·L-1,工作一段时间后,测得导线上均通过0.02 mol电子,若不考虑溶液体积的变化,则下列叙述正确的是
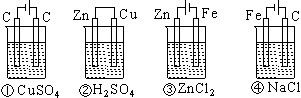
A.工作一段时间后溶液的浓度①=②=③=④
B.工作一段时间后溶液的pH:④>③>①>②
C.产生气体的总体积:④>③>①>②
D.电极上析出的固体的质量:①>②>③>④
3. 酸性高锰酸钾能将醇氧化生成一系列产物,反应中KMnO4被还原为Mn2+,用0.60 mol·L-1的酸性高锰酸钾溶液滴定20.0 mL0.50 mol·L-1的乙二醇溶液,当用去20.0 mL高锰酸钾溶液时,再滴加1滴高锰酸钾溶液时,溶液刚好呈紫色,振荡后不褪色。则乙二醇的氧化产物为
A.OHC-CHO B.HOOC-COOH C.HOOC-CHO D.CO2
2. 某容器中发生一个化学反应,反应过程中存在As2S3、HNO3、H2SO4、NO、H3AsO4、H2O六种物质,已知As2S3是反应物之一。下列有关判断不正确的是
A.该容器中发生了氧化还原反应
B.该反应中HNO3、H2O是反应物,H2SO4、NO、H3AsO4是生成物
C.该反应中只有砷元素被氧化、只有氮元素被还原
D.氧化产物和还原产物的物质的量之比为15:28
1. 科学家在多年前就探测到火星大气中存在微量的羰基硫(COS)。已知能发生下列反应:CO+S COS,2COS+SO2
COS,2COS+SO2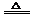 2CO2+3S。下列说法不正确的
2CO2+3S。下列说法不正确的
A.利用这两个反应可以消除CO、SO2的污染 B.两反应均属于氧化还原反应
C.两反应均不属于离子反应 D.前者属于化合反应,后者属于置换反应
4.电解原理的应用
①氯碱工业:即电解饱和食盐水(制取烧碱和氯气)的工业。其反应原理是:阳极2Cl--2e-=Cl2↑,阴极2H++2e-=H2↑,总反应2NaCl+2H2O 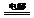 2NaOH+H2↑+Cl2↑。
2NaOH+H2↑+Cl2↑。
②电镀:是特殊的电解。电镀时,用镀层金属做阳极、待镀金属(镀件)做阴极,用含含镀层金属阳离子的电解质溶液。理论上讲,电镀时,电解质溶液的成分是不变的。
③铜的电解精炼:粗铜中通常含有Zn、Fe、Ni、Ag、Au等杂质
|
电极名称 |
电极材料 |
电极反应 |
电解质溶液 |
溶液浓度 |
|
阳极 |
粗铜板 |
Cu-2e-=Cu2+、Fe-2e-=Fe2+、 Ni-2e-=Ni2+ |
CuSO4溶液(加入一定量的硫酸) |
基本保持不变 (或略有下降) |
|
阴极 |
纯铜板 |
Cu2++2e-= Cu |
位于金属活动顺序铜之后的Ag、Au等金属,因为给出电子能力比铜弱,难以在阳极失去电子变成离子溶解下来,当阳极上的Cu失去电子变成离子溶解后,它们以金属单质的形式沉积在电解槽底,形成阳极泥。
④电冶金:电解法冶炼活泼金属。电解法冶炼活泼金属时,电解液是用熔融的金属化合物(通常是氯化物或氧化物),以制取金属钠为例,电解过程中,电极反应式分别是:阳极2Cl--2e-=Cl2↑,阴极2Na++2e-=2Na,总反应式为2NaCl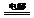 2Na+Cl2↑。
2Na+Cl2↑。
[思想方法]
[例1]1986年,人们成功的用如下反应制得了氟:
①2KMnO4+2KF+10HF+3H2O2=2K2MnF6+8H2O+3O2 ②K2MnF6+2SbF5=2KSbF6+MnF4
③2MnF4=2MnF3+F2↑。下列说法中正确的是
A.反应①、②、③都是氧化还原反应 B.反应①H2O2既是还原剂又是氧化剂
C.氧化性:H2O2>KMnO4 D.每生成1mol F2,上述反应共转移8mol电子
[分析]本题主要考查氧化还原反应中的基本概念。反应①是氧化还原反应,氧化剂是KMnO4,双氧水作还原剂,选项B错。由氧化剂的氧化性大于还原剂的氧化性,可知选项C错,同时可知当有2molK2MnF6生成时转移6mol电子。题中反应②反应前后无元素化合价的升降,是非氧化还原反应,故选项A错。每生成1molF2,反应③转移2mol电子,根据3个反应式可列出关系式1molF2~2molMnF4~2molK2MnF6,结合前面分析:可知反应①转移6mol电子,因此每生成1mol F2,上述反应共转移8mol电子。本题应选D
[例2]在一定条件下有下列反应:
X2 + Y2 + H2O → HXO3 + HY
⑴配平上述氧化还原反应的方程式,并标出电子转移的方向和数目。
⑵反应中还原剂是 ,若有转移2mol 电子,则生成HXO3的物质的量为 mol。
⑶①X2、Y2可能的组合是 (填编号,下同)。
a.Br2 F2 b.I2 Cl2 c.Cl2 O2 d.N2 Br2
②若用KX制取HX,则应该选用的酸是 。
a.稀H2SO4 b.稀HNO3 c.浓H2SO4 d.浓H3PO4
原因是 。
[分析]本题对氧化还原反应进行了综合考查。X2(0→+5)↗5×2×1(1为系数),Y2(0→-1)↘1×2×5 (5为系数),再根据质量守恒定律可知水前面的化学计量数为6,反应的化学方程式表示为X2 + 5Y2 + 6H2O =2HXO3 + 10HY。⑶①反应中Y2作氧化剂,X2作还原剂,由于反应在水溶液中进行,因此Y2不可能是F2,a错,由于Y2的还原产物是HY,因此Y2不可能是O2,c错,若选项d成立,据题意N2的氧化产物HXO3是HNO3,Br2的还原产物HY是HBr,很显然HNO3和HBr在溶液中不能大量共存,因此d错。②若用KX制取HX,由于X是I,根据HI的性质,易挥发,具有强还原性,因此只能选用难挥发性酸(沸点高)和非氧化性酸,因此只有d成立。
答案:⑴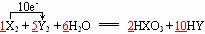 ⑵X2 0.4 ⑶①b ②d 磷酸是非氧化性酸,难挥发性酸
⑵X2 0.4 ⑶①b ②d 磷酸是非氧化性酸,难挥发性酸
 [例3]控制适合的条件,将反应2Fe3++2I-
[例3]控制适合的条件,将反应2Fe3++2I- 2Fe2++I2设计成如图所示的原电池。下列判断不正确的是
2Fe2++I2设计成如图所示的原电池。下列判断不正确的是
A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为
负极
[分析]本题中涉及的是带有盐桥的原电池,是课标中的新增内容,
盐桥的存在可使氧化还原反应在同时而不同地进行,大大提高电
流的效率。但其工作原理和不带盐桥的原电池的一样的,即负极
失电子发生氧化反应,正极得电子发生还原反应。对于本题,甲中石墨作正极,发生还原反应,电极
反应式为2Fe3++2e- 2Fe2+,乙中石墨作负极,发生氧化反应,电极反应式为2I--2e-
2Fe2+,乙中石墨作负极,发生氧化反应,电极反应式为2I--2e- I2。当反应
I2。当反应
达到平衡时,正逆反应的速率相等,此时电路中电流强度的和为0,故电流计的读数为0,反之也成
立,选项A、B、C均正确。当电流计读数为零后,在甲中再溶入FeCl2固体,导致化学平衡逆向移动,
即把该反应的逆反应设置成原电池,甲中石墨作负极,发生氧化反应,电极反应式为
2Fe2++2e- 2Fe3+,乙中石墨作正极,发生还原反应,电极反应式为2I2-2e-
2Fe3+,乙中石墨作正极,发生还原反应,电极反应式为2I2-2e- 2I-,D错。本题应选D。
2I-,D错。本题应选D。
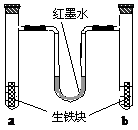 [例4]如图装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间。下列有关描述错误的是
[例4]如图装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间。下列有关描述错误的是
A.生铁块中的碳是原电池的正极
B.红墨水柱两边的液面变为左低右高
C.两试管中相同的电极反应式是:Fe-2e- = Fe2+
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
[分析]粗看装置虽感到陌生,但仔细分析得知该实验是简单吸氧腐蚀与析氢腐蚀的简单综合。a试管内盛装食盐水,溶液呈中性,发生的是吸氧腐蚀,负极反应式为Fe-2e- Fe2+,正极反应式为O2 +
2H2O + 4e-
Fe2+,正极反应式为O2 +
2H2O + 4e- 4OH-,显然a装置内气体的物质的量减少,压强减小。b试管内盛装氯化铵,溶液呈酸性,发生的吸氢腐蚀,负极反应式为Fe-2e-
4OH-,显然a装置内气体的物质的量减少,压强减小。b试管内盛装氯化铵,溶液呈酸性,发生的吸氢腐蚀,负极反应式为Fe-2e- Fe2+,正极反应式为2H++2e-
Fe2+,正极反应式为2H++2e- H2↑,气体的物质的量增加,压强增大。综上分析选项B错。
H2↑,气体的物质的量增加,压强增大。综上分析选项B错。
[例5]市场上经常见到的标记为Li-ion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料。这种锂离子电池的电池反应式为:Li+2Li0.35NiO2 2Li0.85NiO2。下列说法不正确的是
2Li0.85NiO2。下列说法不正确的是
A.放电时,负极的电极反应式:Li-e- Li+
Li+
B.充电时,Li0.85NiO2既发生氧化反应又发生还原反应
C.该电池不能用水溶液作为电解质
D.放电过程中Li+向负极移动
[分析]本题主要考查原电池和电解池的综合。电池放电时,相当于原电池,Li从0价升至+1价,失电子作负极,电极反应式为Li-e- Li+,根据总反应式可知正极反应式为2Li0.35NiO2+e-+Li+
Li+,根据总反应式可知正极反应式为2Li0.35NiO2+e-+Li+ 2Li0.85NiO2,A正确。充电时相当于电解池,由于反应物只有一种,所以放电过程中既发生氧化反应又发生还原反应,B正确。由于金属Li较活泼,能与水反应生成H2,因此电池介质应为非水材料,C正确。在放电过程中,电解质溶液相当于电池的内电路,因此Li+应向正极移动,D错。本题应选D。
2Li0.85NiO2,A正确。充电时相当于电解池,由于反应物只有一种,所以放电过程中既发生氧化反应又发生还原反应,B正确。由于金属Li较活泼,能与水反应生成H2,因此电池介质应为非水材料,C正确。在放电过程中,电解质溶液相当于电池的内电路,因此Li+应向正极移动,D错。本题应选D。
[专题演练]
3.电解的规律
若用惰性电极(如Pt、石墨)进行电解,产物的规律如下(氟化物例外):
|
电解质 |
电 解 产 物 |
结
论 |
|||
|
类
别 |
举
例 |
阳
极 |
阴
极 |
溶液组成 |
|
|
无氧酸、不活泼金属的无氧酸盐 |
HCl CuCl2 |
非金属单质(非O2) |
氢气或金属单质 |
浓度减小,溶质不变。 |
实质是 溶质发生分解 |
|
含氧酸、强碱和活泼金属的含氧酸盐 |
H2SO4 NaOH Na2SO4 |
氧
气 |
氢
气 |
溶质不变,浓度增大。 |
实质是电解水 |
|
活泼金属的 无氧酸盐 |
NaCl |
非金属单质(非O2) |
氢
气 |
有碱生成 |
实质是溶质和水同时分解 |
|
不活泼金属的 含氧酸盐 |
CuSO4 |
氧
气 |
金属单质 |
有含氧酸生成 |
2.串联装置图比较
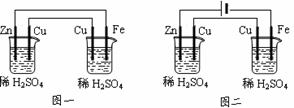
图一中无外接电源,两者必有一个装置是原电池装置(相当于发电装置),为电解装置提供电能,其中两个电极活动性差异大者为原电池装置,如图一中左图为原电池装置,右图为电解装置。图二中有外接电源,两烧杯均作电解池,且串联电解,通过的电流相等。
1.原电池装置与电解装置的比较--有无外接电源。
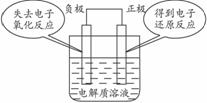
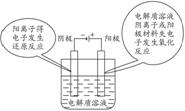
要注意到原电池的两极称为正负极,溶液中放电的阴离子向负极移动,放电的阳离子向正极移动,电解池的两极称为阴阳极,阴阳离子在外加电场的作用下分别向阳极和阴极移动。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com