
25.(5分)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:①Fe2O3(s)+3CO(g)== 2Fe(s)+3CO2(g) △H1= ―24.8kJ/mol
②3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H2= ―47.2kJ/mol
③Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H3= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式(要有推理过程)
|
|
24.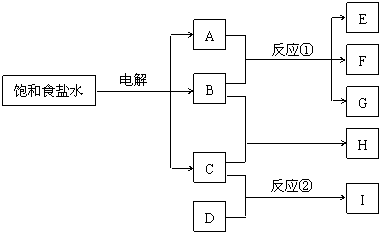 (8分)下列每一方框中的字母代表一种反应物或生成物:
(8分)下列每一方框中的字母代表一种反应物或生成物:
|
|
C |
D |
I |
|
起始组成/mol |
6 |
4 |
0 |
|
某时刻组成/mol |
3 |
3 |
2 |
物质A跟B反应生成物质E、F和G;物质C跟D反应生成物质I,某温度下该反应起始和某时刻的反应混合物组成如上表格所示。(提示:饱和食盐水的电解产物为氢氧化钠、氢气和氯气。)
请填写下列空白:
(1)物质H的化学式是____________。
(2)反应①的化学方程式是__________________________。
(3)反应②的化学方程式(应注明反应条件)是____________________。
23.(6分)发射卫星时可用肼(N2H4)为燃料和二氧化氮做氧化剂,两者反应生成氮气和气态水。
已知: N2H4 (g) + O2 (g) = N2(g) +2H2O (g) △H = -543kJ/mol
N2 (g) + 2O2 (g) = 2NO2 (g) △H = + 67.7kJ/mol
H2 (g) + 1/2O2 (g) = H2O (g) △H = -242kJ/mol
1/2H2 (g) + 1/2F2 (g) = HF (g) △H = -269kJ/mol
(1) 肼和二氧化氮反应的热化学方程式为 ;
(2)有人认为若用氟气代替二氧化氮作氧化剂,则反应释放能量更大,肼和氟气反应的热化学方式: 。
22.(10分)利用盖斯定律可测某些特别反应的热效应。
(1)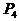 (s,白磷)+
(s,白磷)+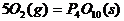
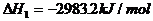
(2)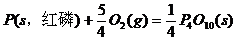
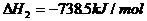
(1)则白磷转化为红磷的热化学方程式为 _。
(2)相同的状况下,能量较低的是_________;白磷的稳定性比红磷___________(填“高”或“低”),原因是 。
21.(11分)(1)已知H+(aq)+OH-(aq)==H2O(l) △H=-57.3kJ/mol。
 回答有关中和反应的问题。
回答有关中和反应的问题。
(1) 用0.1molBa(OH)2配成稀溶液与足量
稀硝酸反应,能放出 kJ热量。
(2) 仪器A的名称 ,
作用是 ;
仪器B的名称 ,
作用是 ;
碎泡沫塑料的作用是 。
(3)若通过实验测定中和热的△H,其结果常常大于-57.3kJ/mol,
其原因可能是
(4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”)。
20.已知两个热化学方程式:
C(s)+O2(g)==CO2(g) △H= ―393.5kJ/mol
2H2(g)+O2(g)==2H2O(g) △H= ―483.6kJ/mol
现有炭粉和H2组成的悬浮气共0.2mol,使其在O2中完全燃烧,共放出63.53kJ的热量,则炭粉与H2的物质的量之比是
A.1︰1 B.1︰2 C.2︰3 D.3︰2
19.下列情况下,反应速率相同的是
A.等体积0.1 mol/L HCl和0.1 mol/L H2SO4分别与0.2 mol/L NaOH溶液反应
B.等质量锌粒和锌粉分别与等量1 mol/L HCl反应
C.等体积等浓度HCl和HNO3分别与等质量的Na2CO3粉末反应
D.等体积0.2 mol/L HCl和0.1 mol/L H2SO4与等量等表面积等品质石灰石反应
18.已知反应:① 2C(s)+O2(g)=2CO(g) ΔH=-221 kJ/mol
② 稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol
下列结论正确的是
A.碳的燃烧热是110.5 kJ/mol
B.①的反应热为221 kJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热为57.3 kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ 热量
17.已知热化学方程式:
H2O(g)=H2(g) + 1/2O2(g) △H = +241.8kJ/mol
H2(g)+ 1/2O2(g) = H2O(1) △H = -285.8kJ/mol
当1g液态水变为水蒸气时,其热量变化是
A.吸热88kJ B. 吸热2.44KJ C.放热44kJ D. 吸热44KJ
16.已知化学反应2C(s)+O2(g)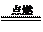 2CO(g);2CO(g) + O2(g)
2CO(g);2CO(g) + O2(g) 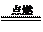 2CO2(g)都是放热反应。据此推断,下列说法不正确的是(相同条件下)
2CO2(g)都是放热反应。据此推断,下列说法不正确的是(相同条件下)
A.56gCO和32gO2所具有的总能量大于88gCO2所具有的总能量
B.12gC所具有的能量一定高于28gCO所具有的能量
C.12gC和32gO2所具有的总能量大于44gCO2所具有的总能量
D.将两份质量相等的碳燃烧,生成CO2的反应比生成CO的反应放出的热量多
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com