
6.(15分)2009年(重庆卷29题)
化合物A由周期不同的短周期元素X、Y组成,是良好的耐热冲击材料。
(1)X的单质既可与盐酸反应,又可与NaOH溶液反应,X的原子结构示意图为 。
(2)X的硫酸盐溶液与过量NaOH溶液反应的离子方程式为
。
(3)一定条件下,A和水缓慢作用生成含Y的化合物Z,Z分子含有10个电子。
①Z与H2O2反应,其产物之一是Y的单质,Y的单质的电子式为 ;Z分子的结构呈 。
②A的化学式是 。
(4)X的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的化合物均由两种元素组成,且都是新型陶瓷材料(在火箭和导弹上有重要应用),其反应的化学方程式是 。
5.(15分 2009年全国卷Ⅱ29题)
现有A、B、C、D、E、F六种化合物,已知它们的阳离子有K+、Ag+、Ca2+、Ba2+、Fe2+、Al3+,阴离子有Cl-、OH-、CH3COO-、NO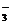 、SO
、SO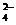 、CO
、CO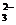 。现将它们分别配成0.1 mol·L-1的溶液,进行如下实验:
。现将它们分别配成0.1 mol·L-1的溶液,进行如下实验:
①测得溶液A、C、E呈碱性,且碱性为A>E>C;
②向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
③向D溶液中滴加Ba(NO3)2溶液,无明显现象;
④向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
根据上述实验现象,回答下列问题:
(1)实验②中反应的化学方程式是
(2)E溶液是 ,判断依据是
(3)写出下列四种化合物的化学式:A 、C 、D 、F 。
4.(2009四川理综)
27 (15分)已知A-O分别代表一种物质,它们之间的转化关系如下图所示(反应条件略去)。A、B、H分别是由短周期元素组成的单质。B与冷水缓慢反应,与沸水迅速反应,放出氢气。D是一种离子化合物,其阴阳离子的个数比为2:3,且能与水反就应得到两种碱。C为淡黄色固体化合物,O能与G的水溶液反应生成蓝色沉淀。
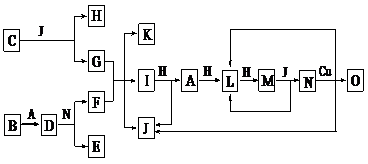
请回答下列问题:
(1)组成B单质的元素位于周期表第____周期,第____族。化合物C的电子式为_____________。
(2)J的沸点比硒化氢(H2Se)的沸点高,其原因是________________________。
(3)写出I与H在点燃条件下反应生成A和J的化学方程式: _________ _____。
(4)写出D与足量的N反应生成E和F的化学方程式: ________ _____。
(5)上图中,在同一反应里一种物质作氧化剂,又作还原剂,这样的反应共有_______个。
3.(2009宁夏理综)
27(15分)下图表示有关物质(均由短周期元素形成)之间的转 化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物。(反应条件图中已省略。)
化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物。(反应条件图中已省略。)
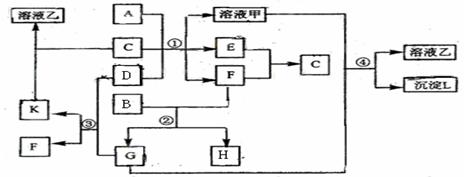
(1)A、B、C、D代表的物质分别为 、 、 、 (填化学式);
(2)反应①中的C、D均过量,该反应的化学方程式是 ;
(3)反应②中,若B与F物质的量之比为4∶3,G、H分别是 、 (填化学式);
(4)反应③产物中K的化学式为 ;
(5)反应④的离子方程式为 。
2.(2009·海南化学卷,13)(9分)有关物质存在如图所示的转化关系(部分产物已省略)。通常C为气体单质,G为紫黑色固体单质。实验室 中,常用固体E在B的催化下加热制取气体单质H。
中,常用固体E在B的催化下加热制取气体单质H。
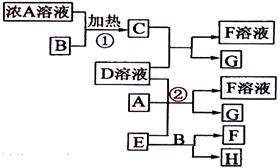
请回答下列问题:
(1)反应①的化学方程式为 。
(2)反应②的离子方程式为 。
(3)写出另外一种实验 室制取H的化学方程式
。
室制取H的化学方程式
。
(4)D溶液与Pb(NO3)2溶液混合可形成沉淀,此沉淀的Ksp = 7.0×10-9。将等体积的D溶液与Pb(NO3)2溶液混合,若D的浓度为1.0×10-2 mo1/L,则生成沉淀所需Pb(NO3)2溶液的最小浓度为 。
1.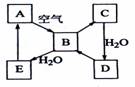 (08海南卷)下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去)。化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料。
(08海南卷)下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去)。化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料。
(1)写出A在加热条件下与H2反应的化学方程式
____________________________________________________________
(2)写出E与A的氢化物反应生成A的化学方程式____________ ____
(3)写出一个由D生成B的化学方程式 __________________;
(4)将5mL0.10mol·L-1的E溶液与10mL0.10 mol·L-1的NaOH溶液混合。
①写出反应的离子方程式__________________________________________;
②反应后溶液的pH ______7(填“大于”、“小于”或“等于”),理由是________;
③加热反应后的溶液,其pH________(填“增大”、“不变”或“减小”),理由是______________________ __________。
27. 地壳中含量最高的元素是O, 金属元素是Al ; 乙烯可用于水果催熟;明矾用于净水;Cl2用于饮用水的杀菌消毒等等。
[无机框图推断高考真题训练]
26. 光照:HClO分解、AgNO3分解、H2与Cl2爆炸
七﹑特殊的存在与用途:
25. 高温:Fe与H2O(g)、CaCO3分解、铝热反应、CO还原Fe2O3、C还原SiO2、C与水蒸气、电解Al2O3
24. 既能与强氧化剂又能与强还原剂反应的常见物质:S、SO2、SO32-﹑HSO3-﹑CO、H2O2、Fe2+、S2O32-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com