
5. (15分)
(15分)
 (1)AgNO3+NH3·H2O=AgOH↓+NH4NO3
(1)AgNO3+NH3·H2O=AgOH↓+NH4NO3
 AgOH+ 2NH3·H2O=Ag(NH3)2OH+2
H2O
AgOH+ 2NH3·H2O=Ag(NH3)2OH+2
H2O
 (2)碳酸钾 由①中碱性强弱的顺序可知,E是碳酸盐。六种阳离子中可以与碳酸根形成可溶性盐的只有钾离子,所以E是碳酸钾
(2)碳酸钾 由①中碱性强弱的顺序可知,E是碳酸盐。六种阳离子中可以与碳酸根形成可溶性盐的只有钾离子,所以E是碳酸钾
 (3)Ba(OH)
(3)Ba(OH)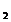 Ca(CH
Ca(CH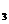 COO)
COO)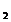 AlCl
AlCl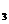 FeSO
FeSO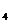
 [解析]本题考查离子共存、盐类水解综合运用。根据溶液的性质,确定CO32-只能与K+形成显碱性的溶液,另外可能形成的碱性溶液为碱Ba(OH)2 。由于醋酸的酸性大于碳酸,所以醋酸盐水解的碱性小于碳酸盐,因此A为Ba(OH)2,E为K2CO3,C为醋酸盐,由②可得B中阳离子为Ag+,则肯定为AgNO3,由③可得D中无SO42-,则F中的阴离子为SO42-,D中的阴离子为Cl-。由④可得F中的阳离子为Fe2+,即F为FeSO4,而CH3COO-若与Al3+形成溶液时,Al3+也发生水解,所以C为醋酸钙,而D为AlCl3。
[解析]本题考查离子共存、盐类水解综合运用。根据溶液的性质,确定CO32-只能与K+形成显碱性的溶液,另外可能形成的碱性溶液为碱Ba(OH)2 。由于醋酸的酸性大于碳酸,所以醋酸盐水解的碱性小于碳酸盐,因此A为Ba(OH)2,E为K2CO3,C为醋酸盐,由②可得B中阳离子为Ag+,则肯定为AgNO3,由③可得D中无SO42-,则F中的阴离子为SO42-,D中的阴离子为Cl-。由④可得F中的阳离子为Fe2+,即F为FeSO4,而CH3COO-若与Al3+形成溶液时,Al3+也发生水解,所以C为醋酸钙,而D为AlCl3。

4.答案:(1)三、II A、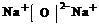 或
或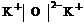 。
。
(2)水分子之间存在氢键,比硒化氢的分子间作用力强。
(3)4NH3+3O2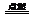 2N2+6H2O(3分)
2N2+6H2O(3分)
(4)Mg3N2+8HNO3 = 3Mg(NO3)2+2NH4NO3。
(5)2。
[解析]“B与冷水缓慢反应,与沸水迅速反应,放出氢气”,这是单质镁的性质,由此推知A是N2,D是Mg3N2。再根据“C为淡黄色固体化合物,O能与G的水溶液反应生成蓝色沉淀”推知C是Na2O2,H是O2,G是NaOH,J是H2O,能够跟O2反应生成N2的I应该是NH3,L是NO,M是NO2,N是硝酸,O是硝酸铜。最后确定F是硝酸铵,E是硝酸镁,K是硝酸钠。做出正确推断后,相关问题就迎刃而解了。
(3)氨在无催化剂存在时在纯氧中燃烧生成N2。
(5)Na2O2、NO2与水的反应都是歧化反应,Na2O2、NO2既做氧化剂又做还原剂。
3.答案:(1)Al C Na2O2 (2)2H2O +Na2O2 =4NaOH+O2↑ 2Al+ 2NaOH+2H2O=2NaAlO2+3H2↑
(3)CO2 CO (4)Na2CO3 (5)2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
[解析]D是淡黄色的固体化合物是本题的突破口,根据中学化学知识基本锁定Na2O2,能与水和CO2反应,但是题目另一信息C是常见的无色无味液体说明C是水,则G为CO2;再依据K能溶于水,说明K为Na2CO3 ,F为O2; 题给信息黑色单质B与氧气(F)反应得到G(CO2),说明B为C(碳);依据F(O2)与E反应生成C(水)可知E为氢气,再根据金属A与碱性溶液反应产生氢气,可得到A为Al.
[点评]本题框图复杂,纵横交错,难度较大,但是若找到Na2O2这个突破口,本题也就迎刃而解了。
2. 答案:(1)反应①的方程式:4HCl(浓)+MnO2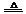 MnCl2+Cl2↑+2H2O(2分)
MnCl2+Cl2↑+2H2O(2分)
(2)反应②的离子方程式:6I-+ClO3- +6H+ = 3I2+Cl-+3H2O(2分)
(3)2H2O2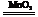 2H2O+O2↑或2KMnO4
2H2O+O2↑或2KMnO4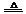 K2MnO4+MnO2+O2↑(其它合理答案也给分)(2分)
K2MnO4+MnO2+O2↑(其它合理答案也给分)(2分)
(4)5.6×10-4 mol·L-1 (3分)
[解析]首先得破框图,G为紫黑色固体单质,一般可预测为碘单质,可推得C物质为氯气,则A为盐酸、B为二氧化锰;E在二氧化锰的催化下制取H,则E为氯酸钾、H为氧气;F为氯化钾;于是D一定为碘化钾。所以推出A盐酸、B二氧化锰、C氯气、D碘化钾、E氯酸钾、F氯化钾、G碘、H氧气。
(4)D溶液与Pb(NO3)2 反应生成沉淀为PbI2,PbI2 Pb2++2I-
Pb2++2I-
Ksp = c(Pb2+) ·c(I-)2 = c(Pb2+)÷2×(10-2÷2)2 = 7.0×10-9
·c(I-)2 = c(Pb2+)÷2×(10-2÷2)2 = 7.0×10-9
所以c(Pb2+) = 5.6×10-4 mol·L-1。
12、(08全国Ⅱ卷)(13分)某钠盐溶液可能含有阴离子NO3-、CO32-、SO32-、
SO42-、Cl-、Br-、I-、为鉴别这些离子,分别取少量溶液进行以下实验:
①测得混合液呈碱性;
②加HCl后,生成无色无味气体,该气体能使饱和石灰水溶液变浑浊;
③加CCl4后,滴加少量氯水,振荡后,CCl4层未变色;
④加BaCl2溶液产生白色沉淀,分离,在沉淀中加入足量盐酸,沉淀不能完全溶解;
⑤加HNO3酸化后,再加过量AgNO3,溶液中析出白色沉淀。
(1)分析上述5个实验,写出每一步实验鉴定离子的结论与理由。
实验① ;
实验② ;
实验③ ;
实验④ ;
实验⑤ ;
(2)上述5个实验不能确定是否存在的离子是 。
[无机框图推断高考真题训练答案]
1[解析]固态单质A能与空气中的氧气反应生成气体物质B,则A可能为C或S等,假定为S,则B为SO2,C为SO3,它们的相对分子质量为64∶80=4∶5,恰好与题意相符(同时也证明A不是C),则D为H2SO4,它是一种重要的工业原料,与题意也相符,进一步证明A为S。E为H2SO3。
[答案](1)H2+S H2S(写成可逆反应也正确)。
H2S(写成可逆反应也正确)。
(2)H2SO3 + 2H2S=3S + 3H2O。
(3)C+2H2SO4(浓) CO2 ↑+2SO2
↑+2H2O
CO2 ↑+2SO2
↑+2H2O
或Cu+ 2H2SO4(浓) CuSO4 +SO2
↑+ 2H2O等。
CuSO4 +SO2
↑+ 2H2O等。
(4)①H2SO3 +2OH- = SO32- + 2H2O。
②大于;Na2SO3溶液中SO32-发生水解使溶液显碱性。
③增大;升高温度促进Na2SO3溶液的水解。
11.(08北京卷)由Fe2O3、Fe、CuO、C、Al中的几种物质组成的混合粉末,取样进行下列实验(部分产物略去):
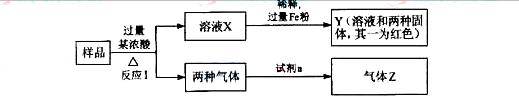
(1)取少量溶液X,加入过量的NaOH溶液,有沉淀生成。取上层清液,通入CO2,无明显变化,说明样品中不含有的物质是(填化学式)________________。
(2)Z为一种或两种气体:
①若Z只为一种气体,试剂a为饱和NaHCO3溶液,则反应Ⅰ中能同时生成两种气体的化学方程式是______________________________。
②若Z为两种气体的混合物,试剂a为适量的水,则Z中两种气体的化学式是________________。
(3)向Y中通入过量的Cl2,并不断搅拌,充分反应后,溶液中的阳离子是(填写离子符号)________________。
(4)取Y中的溶液,调节pH约为7,加入淀粉KI和H2O2,溶液呈蓝色并有红褐色沉淀生成。当消耗2molI-时,共转移3mol电子,该反应的离子方程式是_________________________________。
(5)另取原样品,加入足量稀硫酸充分反应,若溶液中一定不会产生Y中的红色固体,则原样品中所有可能存在的物质组合是(各组合中物质用化学式表示)____________。
10.(08江苏卷)根据下列框图回答问题(答题时,方程式中的M、E用所对应的元素符号表示):
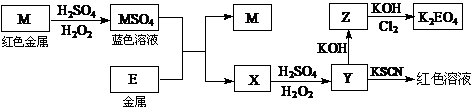
⑴写出M溶于稀H2SO4和H2O2混合液的化学方程式: 。
⑵某同学取X的溶液,酸化后加入KI、淀粉溶液,变为蓝色。写出与上述变化过程相关的离子方程式: 、 。
⑶写出Cl2将Z氧化为K2EO4的化学方程式: 。
 ※⑷由E制备的E(C2H5)2的结构如右图,其中氢原子的化学环境完全相同。但早期人们却错误地认为它的结构为:
※⑷由E制备的E(C2H5)2的结构如右图,其中氢原子的化学环境完全相同。但早期人们却错误地认为它的结构为: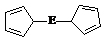 。核磁共振法能够区分这两种结构。在核磁共振氢谱中,正确的结构有 种峰,错误的结构有 种峰。
。核磁共振法能够区分这两种结构。在核磁共振氢谱中,正确的结构有 种峰,错误的结构有 种峰。
9.(08全国Ⅰ卷)V、W、X、Y、Z是由周期表中1-20号部分元素组成的5种化合物,其中V、W、X、Z均为两种元素组成,上述5种化合物涉及的所有元素的原子序数之和等于35。它们之间的反应关系如下图:
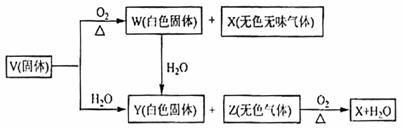
(1)5种化合物分别是V 、W 、X 、Y 、Z 。(填化学式)
(2)由上述5种化合物中2种化合物反应可生成一种新化合物,它包含了5种化合物中的所有元素,生成该化合物的化学方程式是 。
(3)V的电子式是 。
8.(08上海卷)(A)如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定)。试回答下列问题:
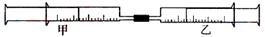
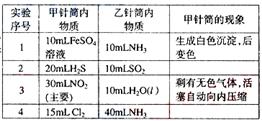
(1)实验1中,沉淀最终变为________色,写出沉淀变色的化学方程式_______________________________。
(2)实验2甲针筒内的现象是:有___________生成,活塞________移动(填向外、向内、不)。反应后甲针筒内有少量的残留气体,正确的处理方法是将其通入___________溶液中。
(3)实验3中,甲中的3mL气体是NO2和N2O4的混合气体,那么甲中最后剩余的无色气体是_______,写出NO2与H2O反应的化学方程式为_______________________________。
(4)实验4中,已知:3Cl2+2NH3 N2+6HCl。甲针筒出活塞有移动,针筒内有白烟产生外,气体的颜色变为____________。最后针筒内剩余气体的体积约为________mL。
N2+6HCl。甲针筒出活塞有移动,针筒内有白烟产生外,气体的颜色变为____________。最后针筒内剩余气体的体积约为________mL。
7.(14分)2009年(浙江卷26题)
各物质之间的转化关系如下图,部分生成物省略。C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10。D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷电路板。

请回答下列问题:
(1)写出A的化学式________,C的电子式________。
(2)比较Y与Z的原子半径大小________>________(填写元素符号)。
(3)写出反应②的化学方程式(有机物用结构简式表示)________,举出该反应的一个应用实例________。
(4)已知F溶于稀硝酸,溶液变成蓝色,放出无色气体。请写出该反应的化学方程式:____________________________________________。
(5)研究表明:气体D在一定条件下可被还原为晶莹透明的晶体N,其结构中原子的排列为正四面体,请写出N及其2种同素异形体的名称________、________、________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com