
4.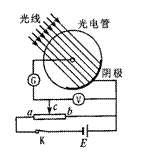 用如图所示的装置研究光电效应现象,用光子能量为2.5 eV的光照射到光电管上时,电流表G示数不为0.移动变阻器的触点c,当电压表的示数大于或等于0.7V时,电流表示数为0.则
用如图所示的装置研究光电效应现象,用光子能量为2.5 eV的光照射到光电管上时,电流表G示数不为0.移动变阻器的触点c,当电压表的示数大于或等于0.7V时,电流表示数为0.则
A.光电管阴极的逸出功为1.8eV
B.电键K断开后,有电流流过电流表G
C.光电子的最大初动能为0.7 eV
D.改用能量为1.5 eV的光子照射,电流表G也有电流,但电流较小
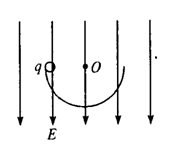
3.如图所示,绝缘光滑的半圆轨道位于竖直平面,竖直向下的匀强电场正穿过其中,在轨道的上缘有一个质量为m,带电荷量为+q的小球,由静止开始沿轨道运动.下列说法正确的是
A.小球运动过程中机械能守恒
B.小球在轨道最低点时速度最大
C.小球在最低点对轨道的压力为mg+qE
D.小球在最低点对轨道的压力为3(mg+qE)
2.在粗糙的水平地面上运动的物体,从a点开始受到一个水平恒力F的作用沿直线运动到b点.已知物体在b点的速度与在a点的速度大小相等,则从a到b
A.物体不一定做匀速运动
B.F方向始终与摩擦力方向相反
C.F与摩擦力对物体的总功一定为零
 D.F与摩擦力对物体的总冲量一定为零
D.F与摩擦力对物体的总冲量一定为零
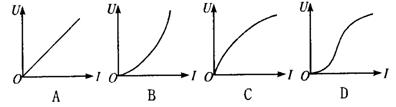
1.一个标有“220 V 60 W”的白炽灯加上由零开始逐渐增加到220 V的电压U,此过程中U和I的关系如果用以下几条图线表示,不可能的是
12、[解析]本题根据实验现象判断可能存在的离子,根据①知该混合液水解显碱性,可能存在CO32-和SO32-,由②知放出的气体为CO2,故存在CO32-,而不存在SO32-,因为SO32-和H+作用放出的SO2有刺激性气味;由③知不含Br-、I-,滴入氯水可以和Br-、I-作用使溶液呈现出溴水或碘水的特殊颜色;由④知,白色沉淀溶于盐酸的是BaCO3,不溶于盐酸的是BaSO4;由⑤判断白色沉淀为AgCl,即含有Cl-,不能确定的是NO3- 离子。
[答案]
(1)①CO32-和SO32-可能存在,因为它们水解显碱性。②肯定存在CO32-离子,不存在SO32-,因为:CO32-+2H+=CO2↑(无色无味)+H2O Ca(OH)2+CO2==CaCO3↓+H2O (SO2具有刺激性气味)。 ③肯定不存在Br-、I-,因为没有溴和碘的颜色出现。④肯定存在SO42-。因为BaSO4不溶于盐酸。⑤Cl-存在.因与 Ag+形成白色沉淀.
(2) NO3-
点评:解答此类混合液中离子的检验问题,要求考生不但要熟练所学离子的性质,同时还要与一些基础实验的操作、现象的表述以及鉴别方案的设计相结合。这些物质中的离子检验题要根据实验现象,推断出混合物里肯定存在、肯定不存在和可能存在的物质。即要注意根据每一步实验现象都应考虑到一定有,一定没有(不共存性),可能有。因此在鉴别物质时应从所加试剂、反应现象、干扰离子等方面去考虑,养成严谨、认真思考分析问题的好习惯。
11.[解析]根据题给物质,包括Fe2O3,Fe,CuO,C,Al,根据(1)中现象,可知不含Al,Y为亚铁盐溶液,固体为Cu和Fe;Z为一种气体时,浓酸为硫酸,其:C+2H2SO4(浓) CO2↑+2SO2↑+2H2O,通过碳酸氢钠后,气体只有CO2, 若是两种气体时,浓酸为硝酸,C+4HNO3=CO2↑+4NO2↑+2H2O,通过水后,气体为CO2和NO;向Y中通入过量氯气,生成的FeCl3逐渐与铁粉和铜粉反应生成CuCl2和FeCl3,溶液阳离子为Cu2+,Fe3+和H+;氯化亚铁溶液中加淀粉碘化钾和H2O2时,其反应为:2Fe2++3H2O2+4I-=2Fe(OH)3↓+2I2;原样品中加足量稀硫酸,Y溶液中不出现红色固体,则原样品中不存在铁和铝,故其可能组合为:CuO和C或CuO、C和Fe2O3。
CO2↑+2SO2↑+2H2O,通过碳酸氢钠后,气体只有CO2, 若是两种气体时,浓酸为硝酸,C+4HNO3=CO2↑+4NO2↑+2H2O,通过水后,气体为CO2和NO;向Y中通入过量氯气,生成的FeCl3逐渐与铁粉和铜粉反应生成CuCl2和FeCl3,溶液阳离子为Cu2+,Fe3+和H+;氯化亚铁溶液中加淀粉碘化钾和H2O2时,其反应为:2Fe2++3H2O2+4I-=2Fe(OH)3↓+2I2;原样品中加足量稀硫酸,Y溶液中不出现红色固体,则原样品中不存在铁和铝,故其可能组合为:CuO和C或CuO、C和Fe2O3。
[答案]
10.[答案] ⑴Cu + H2O2 + H2SO4 == CuSO4 + 2H2O
⑵4Fe2+ + O2 + 4H+ == 4Fe3+ + 2H2O 2Fe3+ + 2I- == 2Fe2+ + I2
⑶10KOH + 3Cl2 + 2Fe(OH)3 == 2K2FeO4 + 6KCl + 8H2O
⑷1 3
9.[解析]此题的关键V由两种元素组成,且V+H2O Y(白色固体)+Z(无色气体),在中学阶段常见的有Na2O2、Mg3N2、CaC2,很明显Na2O2不满足V+O2
Y(白色固体)+Z(无色气体),在中学阶段常见的有Na2O2、Mg3N2、CaC2,很明显Na2O2不满足V+O2 W(白色固体)+X(无色气体),若为Mg3N2,则Y为Mg(OH)2,Z为NH3,X可能为NO,W为MgO,所有的原子序数的总和为28,与题意不符;若为CaC2,则Y为Ca(OH)2,根据Y逆推W为CaO,Z为C2H2,X为CO2,其中C、H、O、Ca的原子序数的总和为36,与题意符合。
W(白色固体)+X(无色气体),若为Mg3N2,则Y为Mg(OH)2,Z为NH3,X可能为NO,W为MgO,所有的原子序数的总和为28,与题意不符;若为CaC2,则Y为Ca(OH)2,根据Y逆推W为CaO,Z为C2H2,X为CO2,其中C、H、O、Ca的原子序数的总和为36,与题意符合。
[答案]
(1)CaC2;CaO;CO2;Ca(OH)2;C2H2。
(2)Ca(OH)2+2CO2===Ca(HCO3)2。
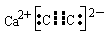 (3) 。
(3) 。
8.[解析](1)NH3+H2O NH3·H2O,FeSO4+2NH3·H2O===Fe(OH)2↓+(NH4)2SO4,
NH3·H2O,FeSO4+2NH3·H2O===Fe(OH)2↓+(NH4)2SO4,
4Fe(OH)2+O2+2H2O===4Fe(OH)3,Fe(OH)3为红褐色。
(2)H2S+SO2===3S+2H2O,S为黄色固体,反应后针筒内的压强降低,所以针筒内的活塞向内压缩,反应后甲针筒内剩余的少量气体不管是SO2还是H2S或其混合物均可用NaOH溶液吸收。
(3)3NO2+H2O===2NHO3+NO,N2O4 2NO2,所以最后剩余的气体为NO。
2NO2,所以最后剩余的气体为NO。
(4)由方程式可知,随着反应的进行,Cl2的量逐渐减少,最终完全反应。
3Cl2+2NH3===N2+6HCl
15mL 10mL 5mL 30mL
剩余的NH3为30mL,由NH3+HCl===NH4Cl可知,生成的HCl与剩余的NH3恰好完全反应生成NH4Cl,所以最后剩余的气体为5mL。
[答案] (1)红褐色;4Fe(OH)2+O2+2H2O 4Fe(OH)3↓。
4Fe(OH)3↓。
(2)黄色固体;向内;NaOH。
(3)NO;3NO2+H2O 2HNO3+NO。 (4)黄绿色变为无色;5。
2HNO3+NO。 (4)黄绿色变为无色;5。
7.(14分)(1)Cu2(OH)2CO3[Cu(OH)2·CuCO3]或CuCO3 
(2)C>O
(3)CH2OH(CHOH)4CHO+2Cu(OH)2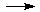 CH2OH(CHOH)4COOH+Cu2O↓+2H2O
CH2OH(CHOH)4COOH+Cu2O↓+2H2O
(4)3Cu2O+14HNO3=6Cu(NO3)2+2NO↑+7H2O
(5)金刚石、石墨、富勒烯(C60)或碳纳米管等
医学上可用这个反应检验尿液中的葡萄糖。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com