
16.( 15 分)V、W、X、Y、Z 是由周期表中1-20 号部分元素组成的5 种化合物,其中V、W、X、Z 均为两种元素组成.上述5 种化合物涉及的所有元素的原子序数之和等于35 。它们之间的反应关系如下图:
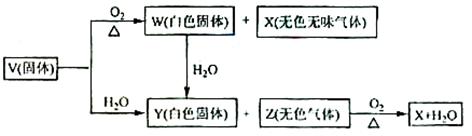
(1)5种化合物分V________,W________,X_________,Y_________
Z________ (填化学式);
(2)由上述5 种化合物中的某2 种化合物反应可生成一种新化合物.它包含了5 种化合物中的所有元素.生成该化合物的化字方程式是__________________________;
(3)V的电子式是________________________。
15.(15分) 短周期元素Q、R、T、W在元素周期表中的位置如右图所示,期中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如右图所示,期中T所处的周期序数与主族序数相等,请回答下列问题:
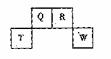
 (1)T的原子结构示意图为_______.
(1)T的原子结构示意图为_______.
 (2)元素的非金属性为(原子的得电子能力):Q______W(填“强于”或“弱于”)。
(2)元素的非金属性为(原子的得电子能力):Q______W(填“强于”或“弱于”)。
 (3) W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为_____.
(3) W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为_____.
 (4)原子序数比R多1的元素是一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是__________.
(4)原子序数比R多1的元素是一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是__________.
 (5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氯气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是__________.
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氯气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是__________.
 (6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的
(6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的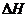 =________(注:题中所设单质均为最稳定单质)
=________(注:题中所设单质均为最稳定单质)
13.(15分)已知周期表中,元素Q、R、W、Y与元素X相邻。Y的最高化合价氧化物的水化物是强酸。回答下列问题:
(1)W与Q可以形成一种高温结构陶瓷材料。W的氯化物分子呈正四面体结构,W的氧化物的晶体类型是 ;
(2)Q的具有相同化合价且可以相互转变的氧化物是 ;
(3)R和Y形成的二元化合物中,R呈现最高化合价的化合物的化学式是 ;
(4)这5个元素的氢化物分子中,①立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式) ,其原因是 ;
②电子总数相同的氢化物的化学式和立体结构分别是 ;
(5)W和Q所形成的结构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCL气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是 。
14.(15分)化合物A由周期不同的短周期元素X、Y组成,是良好的耐热冲击材料。
(1) X的单质既可与盐酸反应,又可与NaOH溶液反应,X的原子结构示意图为 。
(2) X的硫酸盐溶液与过量NaOH溶液反应的离子方程式为
(3) 一定条件下,A和水缓慢作用生成含Y的化合物Z,Z分子含有10个电子。
①Z与H2O2反应,其产物之一是Y的单质,Y的单质地电子式为 ;Z分子的结构呈
②A的化学式是
(4)X的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的化合物均由两种元素组成,且都是新型陶瓷材料(在火箭和导弹上有重要应用),其反应的化学方程式是
12. X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是
 A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
 B.元素X不能与元素Y形成化合物
B.元素X不能与元素Y形成化合物
 C.元素Y、R分别与元素X形成的化合物的热稳定性:
C.元素Y、R分别与元素X形成的化合物的热稳定性: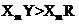
 D.元素W、R的最高价氧化物的水化物都是强酸
D.元素W、R的最高价氧化物的水化物都是强酸
11. 由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如在右图转化关系(部分生成物和反应条件略去)下列推断不正确的是
由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如在右图转化关系(部分生成物和反应条件略去)下列推断不正确的是
A.若X是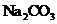 ,C为含极性键的非极性分子,则A一定是氯气,且D和E不反应
,C为含极性键的非极性分子,则A一定是氯气,且D和E不反应
B.若A是单质,B和D的反应是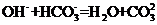 ,则E一定能还原
,则E一定能还原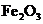
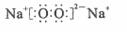 C.若D为CO,C能和E反应,则A一定为
C.若D为CO,C能和E反应,则A一定为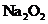 ,其电子式是
,其电子式是
D.若D为白色沉淀,与A摩尔质量相等,则X一定是铝盐
9.下列叙述正确的是 A. HF、HCl、HBr、HI稳定性依次增强 B. PCl3和BCL3分子中所有原子的最外层都达到8电子稳定结构 C. H2S和CS2分子都是含极性键的极性分子 D.熔点由高到低的顺序是:金刚石>碳化硅>晶体硅
10. X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻。X的核电荷数是Y是核外电子数的一半,Y与M可形成化合物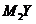 。下列说法正确的是
。下列说法正确的是
A. 还原性:X的氧化物>Y的氧化物>Z的氢化物
B. 简单离子的半径:M的离子>Z的离子>Y的离子>X的离子
C.
YX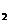 、M
、M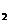 Y都是含有极性键的极性分子
Y都是含有极性键的极性分子
D. Z元素的最高价氧化物的水化物的化学式为HZO4
8.下列叙述中正确的是

 A. 向含有CaCO3沉淀的水中通入CO2 至沉淀恰好溶解,再向溶液中加入NaHCO3
饱
A. 向含有CaCO3沉淀的水中通入CO2 至沉淀恰好溶解,再向溶液中加入NaHCO3
饱
 和溶液,又有CaCO3沉淀生成
和溶液,又有CaCO3沉淀生成

 B. 向Na2
CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2 CO3的物质的量之比为1:2.
B. 向Na2
CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2 CO3的物质的量之比为1:2.

 C.等质量的NaHCO3和Na2 CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同
C.等质量的NaHCO3和Na2 CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同

 D. 向Na2
CO3饱和溶液中通入CO2,有NaHCO3结晶析出
D. 向Na2
CO3饱和溶液中通入CO2,有NaHCO3结晶析出
6.下列说法中正确的是
A.离子晶体中每个离子周围均吸引着6个带相反电荷的离子
B.金属导电的原因是在外电场作用下金属产生自由电子,电子定向移动
C.分子晶体的熔沸点很低,常温下都呈液态或气态
D.原子晶体中的各相邻原子都以共价键相结合
7.已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol

 Na2O2(s)+CO2(g)=Na2CO3(s)+
Na2O2(s)+CO2(g)=Na2CO3(s)+
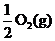 ΔH=-226 kJ/mol
ΔH=-226 kJ/mol
 根据以上热化学方程式判断,下列说法正确的是
根据以上热化学方程式判断,下列说法正确的是
 A.CO的燃烧热为283
kJ
A.CO的燃烧热为283
kJ
 B.右图可表示由CO生成CO2的反应过程和能量关系
B.右图可表示由CO生成CO2的反应过程和能量关系
 C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol
 D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
5. 元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是
元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是
A.同一元素不可能既表现金属性,又表现非金属性
 B.第三周期元素的最高正化合价等于它所处的主族序数
B.第三周期元素的最高正化合价等于它所处的主族序数
 C.短周期元素形成离子后,最外层电子都达到8电子稳定结构
C.短周期元素形成离子后,最外层电子都达到8电子稳定结构
 D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同
D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同
4.设NA为阿伏加德罗常数,下列说法正确的是:
A.标准状况下,5.6 L四氯化碳含有的分子数为0.25 NA
B.标准状况下,14 g氨气含有的核外电子数为5NA
C.标准状况下,22.4 L任意比的氢气和氯气的混合气体中含有的分子总数均为NA
D.标准状况下,铝跟氢氧化钠溶液反应生成1 mol氢气时,转移的电子数为NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com