
17.(5分)
某学生做元素性质递变实验时自己设计了一套方案,并记录了有关实验现象如下表:
|
实验方案 |
实验现象 |
|
1.用砂纸打磨后的镁带与水反应,再向反应后溶液中滴加酚酞 |
(A)浮在水面上,熔化化成小球,四处浮动,最终消失,溶液变红 |
|
2.向新制的氢硫酸饱和溶液中滴加新制的氯水 |
(B)产生气体,可在空气中燃烧,溶液变成浅红色 |
|
3.钠与滴有酚酞的试液的冷水反应 |
(C)反应不十分强烈,产生的气体可在空气中燃烧 |
|
4.镁带与2mol/L的盐酸反应 |
(D)剧烈反应,产生可燃性气体 |
|
5.铝条与2mol/L的盐酸反应 |
(E) |
|
6.向氯化铝溶液中滴加氢氧化钠溶液至过量 |
(F)生成黄色沉淀 |
请你帮助该同学完成实验报告:
(1)实验的目:探究同周期元素的金属性和非金属性的递变规律 。
(2)实验仪器:① ②胶头滴管 ③试管 ④试管夹⑤镊子⑥小刀⑦玻璃片⑧砂纸等
(3)实验内容:
与实验方案1-6对应的实验现象依次为 (填:字母编号)。
实验现象(E)为: 。
(4)实验结论 。
16. 有8 gNa2O2、Na2O、Na2CO3、NaOH混合物与200g质量分数为3.65%的盐酸恰好完全反应,蒸干溶液,最终得到的固体的质量为
有8 gNa2O2、Na2O、Na2CO3、NaOH混合物与200g质量分数为3.65%的盐酸恰好完全反应,蒸干溶液,最终得到的固体的质量为
 A.8g
B. 5.85g
C.11.7g
D.15.5g
A.8g
B. 5.85g
C.11.7g
D.15.5g
 第Ⅱ卷(非选择题:6小题,共52分)
第Ⅱ卷(非选择题:6小题,共52分)
15.下列图像正确的是
A.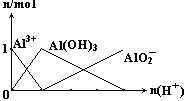 B.
B.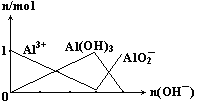
C.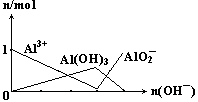 D.
D.
14.下列离子方程式中正确的是
A.实验室用烧碱溶液除去尾气中的Cl2:Cl2+OH-=Cl-+HClO
B.向AlCl3溶液中滴加过量氨水制备Al(OH)3:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
C.氨水中通入过量CO2:2NH3·H2O + CO2 = 2NH4+ + CO32- + H2O
D.用FeCl3溶液腐蚀铜制印刷电路板:Fe3++Cu=Fe2++Cu2+
13. 有4种混合溶液,分别由等体积0.1 mol/L的2种溶液混合而成:
有4种混合溶液,分别由等体积0.1 mol/L的2种溶液混合而成:
 ①CH3COONa与Na2CO3;②CH3COONa与NaCl;③CH3COONa与NaOH;④CH3COONa与HCl。
①CH3COONa与Na2CO3;②CH3COONa与NaCl;③CH3COONa与NaOH;④CH3COONa与HCl。  c(CH3C00一)排序正确的是
c(CH3C00一)排序正确的是
 A.③>①>②>④ B.③>②>①>④
A.③>①>②>④ B.③>②>①>④ C.④>②>①>③ D.④>②>③>①
C.④>②>①>③ D.④>②>③>①
12. 某温度下,向pH=6
某温度下,向pH=6 的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是
的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是
 A.该温度高于25℃
A.该温度高于25℃
 B.由水电离出来的H+的浓度是1.0×10-10mol/L
B.由水电离出来的H+的浓度是1.0×10-10mol/L
 C.加入NaHSO4晶体抑制了水的电离
C.加入NaHSO4晶体抑制了水的电离
 D.该温度下加入等体积pH =
12的NaOH溶液可使该溶液恰好呈中性
D.该温度下加入等体积pH =
12的NaOH溶液可使该溶液恰好呈中性
11.下列判断中一定正确的是
A.CaCl2及CaO2固体中阴、阳离子数之比均为2∶1
B.等质量的O2与O3中,氧原子的个数比为3∶2
C.分别用H2O2、KMnO4分解制O2,当制得等质量O2时,转移电子数之比为1∶2
D.10mL 0.3mol·L-1NaCl与30mL0.1mol·L-1AlCl3溶液中Cl-物质的量浓度比为1∶3
10.常温下,下列溶液可能大量共存的离子组是
A.含有大量S2-的溶液:Na+、C1O-、C1-、CO32-
B.含有大量Fe3+的溶液:K+、Na+、A1O2-、SO42-
C.能使pH试纸变红的溶液:NH4+、Na+、NO3-、HCO3-
D.水电离产生的c(H+)=1×10-12mol·L-1的溶液:Mg2+、SO42-、NO3-、C1-
9.下列实验操作会导致实验结果偏低的是
①配制100 g 10%的CuSO4溶液,称取10 g CuSO4晶体溶于90 g水中
②测定碳酸钠晶体中结晶水的百分含量时,所用的晶体已经受潮
③配制一定物质的量浓度的溶液时,药品与砝码放反了,游码读数为0.2 g
④用酸式滴定管量取用98%,密度为1.84 g/cm3的浓H2SO4配制200mL 2 mol·L-1的稀H2SO4时,先平视后仰视
A.①③ B. ②④ C. ①③④ D.①②③④
8.下列说法正确的是
①标准状况下,22.4 L己烯含有的分子数为6.02×1023
②在同温同体积时,气体物质的物质的量越大,则压强越大
③7.1 g氯气与足量的氢氧化钠溶液反应转移的电子数约为0.2×6.02×1023
④31 g 白磷中含有6×6.02×1023个P-P键
⑤1 mol乙醇中含有的共价键数约为7×6.02×1023
⑥同温同压下,气体的密度与气体的相对分子质量成正比
A.①④ B.②⑥ C.③⑤ D.②⑤
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com