
5.如果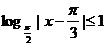 ,那么
,那么 的取值范围是( )
的取值范围是( )
A.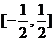 B.
B.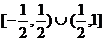 C.
C. 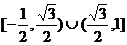 D.
D.
4.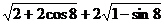 的简化结果为( )
的简化结果为( )
A.4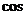 4-2sin4
B.2sin4 C.2sin4-4
4-2sin4
B.2sin4 C.2sin4-4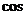 4
D.-2sin4
4
D.-2sin4
3.函数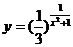 的值域为( )
的值域为( )
A.(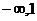 ) B.(
) B.(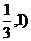 C.
C.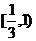 D.
D.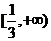
2.为了得到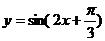 的图象,只需将
的图象,只需将 的图象( )
的图象( )
A.向左平移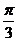 个单位 B.向右平移
个单位 B.向右平移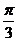 个单位
个单位
C.向左平移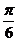 个单位 D.向右平移
个单位 D.向右平移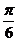 个单位
个单位
1.满足集合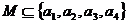 ,且
,且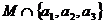 =
=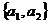 的集合
的集合 的个数是( )
的个数是( )
A.1 B.2 C.3 D.4
22.(8分)
(1)向40mlFeBr2溶液中通入标况下体积为0.672L的Cl2,充分反应后测得溶液中Cl-和Br-的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为 ;
(2)向含1molFeI2和2molFeBr2的溶液中通入3molCl2后,溶液中所含各种离子的个数之比是 ;
(3)向含a mol FeI2和b mol FeBr2的溶液中通入c molCl2,若要保证溶液中含有两种阳离子,c的取值范围是 。
 安徽省无为中学(2009-2010-1)第二次检测试卷
安徽省无为中学(2009-2010-1)第二次检测试卷
21.(8分)现有分子式均为C3H6O2的四种有机物A、B、C、D,且分子中均含甲基,把它们分别进行下列实验以鉴别之,其实验记录如下:
|
|
NaOH溶液 |
银氨溶液 |
新制Cu(OH)2 |
金属钠 |
|
A |
中和反应 |
-- |
溶 解 |
产生氢气 |
|
B |
-- |
有银镜 |
加热后有红色沉淀 |
产生氢气 |
|
C |
水解反应 |
有银镜 |
加热后有红色沉淀 |
-- |
|
D |
水解反应 |
-- |
-- |
-- |
(1)B分子中官能团的名称是
(2)C的结构简式为
(3) D在NaOH溶液中水解反应化学方程式为
(4)属于A的同系物且比A少一个碳原子的物质E的同分异构体有(写结构简式)
20.(13分)A、B、C、D是四种可溶于水的化合物,分别有阳离子K+、Ba2+、Al3+、Fe3+和阴离子OH-、CO32-、NO3-、SO42-两两组合而成,它们的溶液发生如下反应:
①A与B 反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失。
②B与C 反应生成白色沉淀E和气体H;
③C与D 反应生成有色沉淀F和气体H。
(1)分别写出它们的化学式:
A B D E
(2)写出①中再加过量A沉淀量减少的离子方程式:
(3) 胶体F也是一种常用的化学物质,写出制备胶体F的离子方程式: ;提纯胶体F的方法: ;如果用胶体F做电泳实验, 极附近颜色加深。
(4)实验室检验C中阳离子的方法为
(5)气体H的电子式为
19.(9分)
⑴请将下列五种物质:KBrO3、Br2 、I2 、KI、K2SO4分别填入下列对应的横线上,组成一个未配平的化学方程式:
______+______+ H2SO4 → ______+______+______+KBr +H2O ;
⑵该反应中的氧化产物是 ,被还原的是 中(填写化学式)的 元素(填写元素符号);
⑶如果该反应方程式中I2 和 KBr的系数分别是16和2,则
① Br2的系数是 ;
②请将反应物的化学式及配平后的系数填入下列相应的位置中:
 __________
+
__________
+  __________
+
__________
+  H2SO4 →
H2SO4 →
③若转移电子总数为10mol,则反应中I2的物质的量为________ 。
18.(9分)归纳整理是科学学习的重要方法之一。在学习了氧族元素的各种性质后,可归纳整理出如下表所示的表格(部分)。
|
性质\元素 |
8O |
16S |
34Se |
52Te |
|
单质熔点(℃) |
-218.4 |
113 |
|
450 |
|
单质沸点(℃) |
-183 |
444.6 |
685 |
1390 |
|
主要化合价 |
-2 |
-2,+4,+6 |
-2,+4,+6 |
|
|
原子半径 |
逐渐增大 |
|||
|
单质与H2反应情况 |
点燃时易化合 |
加热化合 |
加热难化合 |
不能直接化合 |
请根据表回答下列问题:
(1) 碲的化合价可能有_________________
(2) 氢硒酸有较强的_________(填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生的化学方程式为_______________________________________。
(3) 工业上Al2Te3可用来制备H2Te,完成下列化学方程式:____A12Te3+_____( ) 一( )A1(OH)3↓+( )H2Te↑
(4)已知在常温下,H2和S反应生成17g H2S放出56.1KJ的热量,试写出硫化氢分解的热化学方程式:_______________________ __________。
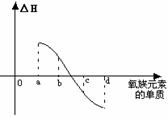
(5) 右图所示为氧族元素单质与H2反应过程中的能量变化示意图,其中a、b、c、d分别表示氧族中某一元素的单质,△H为相同物质的量的单质与H2反应的反应热。则:b代表________________,d代表_____________(均写单质名称)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com