
11、新中国成立前夕,国民经济全面崩溃。但仅过三年时间,工农业生产就超过历史最高水平。这一历史现象出现的根本前提是 ( ) A.新中国的成立 B.过渡时期总路线的提出 C.“一五”计划的执行 D.“社会主义三大改造的完成
10、俄国前总统普京在回答“您怎样看待苏联解体”时,引用俄罗斯家喻户晓的一句话说:“谁不为苏联解体而惋惜,谁就没有良心;谁想恢复过去的苏联,谁就没有头脑。”大多数俄罗斯人不想恢复“过去的苏联”,主要原因是苏联( ) A.片面发展重工业 B.忽视民主与法制 C.体制僵化,社会缺乏活力 D.与美国争夺世界霸权,造成经济困难
9、西方发达国家在“二战”后实行“人民资本主义”,推行社会福利制度的主要目的是( ) A.暂时缓和阶级矛盾,维护社会安定
B.提高劳动者的积极性,刺激经济发展 C.实行社会保险制度,巩固社会秩序 D.防止人民极端贫困和社会动荡
2、列宁对党的内的同志说:“我们在夺取政权后就知道,不存在将资本主义制度具体改造成社会主义制度的现成方法。我不知道哪位社会主义者处理过这些问题。我们必须根据实验做出判断。”列宁进行的比较成功的“实验”是( ) A.战时共产主义政策的实施 B.新经济政策的实施 C.实行工业化和农业集体化 D.建立集中的政治经济体制 3、有人说,“对于苏俄农民而言,1920年的秋天阴云密布,1922年的春天是阳光灿烂。”这里“阳光灿烂”最有可能是因为 ( ) A.农民无偿获得永久属于自己的土地 B.农民纳税后能自由支配剩余的粮食 C.苏维埃政府免去了农民的赋税 D.农民享有优先处理农产品的权利 4、1926年美国出售的汽车约70%是用分期付款的形式进行,当时美国流传的说法是“一美元首付,一美元月供”。这种现象造成的影响是( ) A.市场繁荣 B.汽车制造业发达
C.银行业发达 D.正常的经济秩序被打乱 5、罗斯福实施新政后,有人说美国的经济中心已从华尔街转移到了华盛顿。其含义是( ) A.金融巨头在危机中破产 B.计划经济取代了市场经济 C.政府经济管理职能加强 D.私人资本主义受到限制 6、有的学者认为:危机并不一定就绝对是一件不好的事情。“危机”这个词本身就包含着“危害”和“机会”两层含义。就当今的资本主义发展而言,“机会”是指( ) A.国家获得了对外扩张的时机 B.调整供求矛盾,经济重新获得活力 C.跨国企业重新获得了发展的生机 D.给部分政客提供了有利的政治时机 7、罗斯福新政最能体现的经济学思想是 ( ) A.“发展经济的最佳方法就是自由放任、听之任之、不加干涉。” B.“政府直接插手干预私营企业的自由经营是最可怕的事情。” C.“要达到充分就业,其唯一办法,乃是把投资这件事情由社会来综揽。” D.“政府颁布济贫法只会使穷的境况更趋恶化。” 8、二战后国家垄断资本主义发展反映了( ) A.西方国家对生产关系进行了根本改革 B.从资本主义向社会主义的和平过渡
C.资本主义社会的基本矛盾正在逐渐消失 D.西方国家在一定程度上调整了生产关系,促进了生产力的发展
1、下列对战时共产主义政策的评价,错误的是( )
A.它不是向共产主义过渡的正确政策 B.它的制定是当时形势的需要
C.对巩固苏维埃政权发挥了重要作用 D.是经济发展规律的基本要求
31.(6分)某课外小组通过下列实验测定某试样Ba(OH)2·nH2O中的n值,并用氢氧化钡溶液确定pH=3的一元弱酸HA发生电离的百分率。
(1)称取3.15 g试样溶于蒸馏水配成100 mL溶液,从中取出10.00 mL溶液于锥形瓶中,加2滴指示剂,用0.100 mol / L HCl标准溶液滴定至终点,共消耗标准液20.00 mL,求试样中氢氧化钡的物质的量。
(2)另取3.15g试样加热至失去全部结晶水,称得质量为1.71g,求试样Ba(OH)2·nH2O中的n值。
(3)用上述(1)中的氢氧化钡溶液滴定pH=3的一元弱酸HA的溶液25.00 mL,达到终点时消耗该氢氧化钡溶液12. 50 mL。求一元弱酸HA发生电离的百分率。
高新第一中学09-10学年高二上学期十月月考
30.(6分)t℃时,纯水的KW=1×10-13。计算:
(1)该温度下0.005mol/L的H2SO4溶液中:①C(H+) = mol/L ②C(OH-)= mol/L
③由水电离出的H+浓度= mol/L。
(2)该温度下将0.005mol/L的H2SO4溶液和0.03mol/L的NaOH溶液按体积比为1:1混合,求混合后溶液的PH(写出计算过程)。
29.(4分)只限使用下列试剂:酚酞溶液、石蕊试液、稀氨水、氯化铵晶体、浓盐酸、熟石灰粉末、醋酸铵晶体和蒸馏水。根据①弱碱在水中存在电离平衡②弱碱的阳离子会破坏水的电离平衡。这两种平衡移动均会引起指示剂颜色变化。由此可分别选用上述试剂,设计两个实验证明NH3·H2O是弱碱。请简述实验方法及现象。(已知:醋酸铵溶液呈中性)
(1)应用根据①的实验方法及现象____________________________________________。
(2)应用根据②的实验方法及现象____________________________________________。
28.(11分)某学生为测定未知盐酸溶液的浓度,将1.00mL待测盐酸配制成100mL稀盐酸溶液;以0.14mol·L-1的NaOH溶液滴定上述稀盐酸25.00mL,滴定终点时消耗NaOH溶液15.00mL。该学生用标准0.14mol·L-1 NaOH溶液滴定稀盐酸的实验操作如下:
A、用酸式滴定管取稀盐酸25.00mL,注入锥形瓶中,加入两滴酚酞
B、用稀盐酸溶液润洗酸式滴定管
C、用蒸馏水洗干净滴定管
D、取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2-3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
E、检查滴定管是否漏水
F、另取锥形瓶,再重复操作一次
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
(1)滴定操作的正确顺序是(用序号填写)E→ →D→ → → →F。
(2)碱式滴定管用蒸馏水润洗后,未用标准NaOH溶液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”) 。
(3)在G操作中如何确定终点? 。
(4)如有1mol/L和0.1mol/L的NaOH溶液,应选用 的NaOH溶液,原因是 。
(5)用标准NaOH溶液滴定时,应将标准NaOH溶液注入滴定管 (选填“甲”或“乙”)中。
(6)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则会导致测得的稀盐酸溶液浓度值 (选填“偏大”“偏小”或“无影响”)。
(7)待测盐酸溶液(稀释前的盐酸溶液)的物质的量浓度为 mol/L(计算结果到小数点后二位)。
27.(11分)已知某溶液中只存在OH-、H+、Na+、CH3COO-四种离子:
(1)若溶液中只溶解了一种溶质,该溶质是 (填化学式),上述离子浓度由小到大的顺序是 (填离子的浓度符号顺序)。
(2)若溶液中两种离子浓度关系为c(Na+) =c(CH3COO-),则该溶液显 性(填“酸”、“中”、“碱”)。 该溶液中的溶质可能是 (填化学式)。
(3)若该溶液由体积相等的醋酸和氢氧化钠溶液混合而成,混合后溶液呈酸性,则混合前溶液中的c(CH3COOH)
c(NaOH)(填>或=或<)。该溶液中存在的三个平衡体系是H2O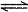 H++OH-、_________________________和__________________________(用离子方程式表示)。
H++OH-、_________________________和__________________________(用离子方程式表示)。
(4)25℃时,将pH=a的醋酸VamL和pH=14-a的氢氧化钠溶液VbmL混合,若溶液显碱性,则Va Vb(填>或=或<)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com