
5.⑴某研究性学习小组为了探究SbCl3、SbCl5、SnCl4三种化合物的成键特点,做了如下实验,其中正确的是________________。
A.观察常温下的状态。SbCl5是苍黄色液体,SnCl4为无色液体。结论:SbCl5和SnCl4都是离子化合物
B.测定SbCl3、SbCl5、SnCl4的熔点依次为73.5℃、2.8 ℃、-33℃。结论:SbCl3、SbCl5、SnCl4都不是离子化合物
C.将SbCl3、SbCl5、SnCl4溶解于水中,滴入HNO3酸化的AgNO3溶液,产生白色沉淀。结论:SbCl3、SbCl5、SnCl4都是离子化合物
D.测定SbCl3、SbCl5、SnCl4的水溶液,发现它们都可以导电。结论:SbCl3、SbCl5、SnCl4都是离子化合物
⑵针对上述正确的实验结论,可判断SbCl3和SnCl4中Sb和Sn的杂化类型分别是________、_______。
⑶实验测得在极性溶剂中SbCl5的溶解度比SbCl3小很多,其主要原因是_______________________。
⑷实验测得同周期的Sb原子比Sn原子的第一电离能大很多,其主要原因______________________。
4. X+、Y+、M2+、N2-均为含有一定数目电子的短周期元素的简单离子,离子半径大小关系是:N2->Y+、Y+>X+、Y+>M2+,下列比较正确的是
A.原子半径:N可能比Y大,也可能比Y小 B.M2+、N2-核外电子数:可能相等,也可能不等
C.原子序数:N>M>X>Y D.碱性:M(OH)2>YOH
3. 下列分子中所有原子都满足最外层8电子结构的是
A.六氟化氙(XeF6) B.次氯酸(HClO) C.氯化硫(S2Cl2) D.三氟化硼(BF3)
2. 下列对HClO分子结构的描述,正确的是
A.O原子发生sp杂化 B.O原子与H、Cl都形成σ键
C.该分子为直线型分子 D.HClO分子的结构式是:H-Cl-O
1. 下列分子的比例模型中,中心原子上存在孤对电子的是
A. B.
B. C.
C. D.
D.
9.四类晶体的基本性质
|
晶体类型 |
离子晶体 |
原子晶体 |
分子晶体 |
金属晶体 |
|
|
熔沸点 |
较高 |
很高 |
一般较低 |
有的高、有的低 |
|
|
硬度 |
硬而脆 |
很硬 |
较小 |
有的软、有的硬 |
|
|
溶解性 |
一般易溶于极性溶剂,难溶于非极性溶剂 |
难溶于一般溶剂 |
极性相似相溶 |
难溶于一般溶剂(Na等与水反应) |
|
|
导 电 性 |
①晶体 |
不导电 |
不导电 |
不导电 |
导电 |
|
②熔融 |
导电 |
不导电 |
一般不导电 |
导电 |
|
|
③溶液 |
溶于水能导电 |
-- |
水溶液能导电 |
-- |
|
|
其他 |
难挥发,密度大 |
不挥发 |
大部分有挥发性 |
延展性、导热性 |
[思想方法]
[例1]文献资料上记载的相对原子质量数据摘录如下:
|
35Cl |
34.969 |
75.77% |
35Cl |
35 |
75.77% |
|
37Cl |
36.966 |
24.23% |
37Cl |
37 |
24.23% |
|
平均 |
35.453 |
平均 |
35.458 |
试回答下列问题
⑴4.969是表示____________;⑵35.453是表示______________;
⑶35是表示_______________;⑷35.458是表示______________;
⑸24.23%是表示___________。
[分析]本题主要考查质量数,核素的原子量,元素的原子量和元素的近似原子量之间的区别与联系,这是本考查点复习中的一个重点也是一个易错点,要深刻领会。⑴ 34.969是表示核素(35Cl)的相对原子质量;⑵35.453是表示氯元素的平均相对原子质量,其计算公式为M=34.969×0.7577+36.969×0.2423=35.453;⑶35是表示氯原子(35Cl)的质量数;⑷35.458是表示氯元素的近似相对原子质量,其计算公式为M=35×0.7577+37×0.2423=35.458;⑸ 24.23%是表示核素(37Cl)所占的原子个数百分比(即丰度)。
[例2]有aA,bB,cC,dD四种短周期元素(稀有气体除外),且有d-c=c-b=b-a=5。已知A、B、C最外层电子数总和大于D最外层电子数。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
⑴下表中的实线表示元素周期表的部分边界,请先用实线补全元素周期表边界,然后把题中所述元素填入到相应的位置。
⑵元素B的单质的结构式为__________,由B和D形成的化合物在工业上常用作杀菌剂,试写出该化合物溶于水的化学方程式______________________________。
⑶C的最高价氧化物对应的水化物与D的最高价氧化物对应的水化物之间相互反应的离子方程式可表示为____________________________。
⑷B的最高价氧化物对应的水化物的稀溶液与C的单质反应时,B被还原到最低价,该反应的化学方程式是___________________________________________。
[分析]A、B、C、D四种元素的原子序数成等差数列,公差等于5,结合题中信息可得如下两种情况:第一组是H、C、Na、S;第二组是He、N、Mg、Cl,再结合A、B、C最外层电子数总和大于D最外层电子数可否定了第一组,只有第二组符合条件。答案为:
⑴
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
He |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
Mg |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
⑵N≡N NCl3+3H2O=NH3↑+3HClO
⑶Mg(OH)2+2H+=Mg2++2H2O
⑷4Mg+10HNO3 = 4Mg(NO3)2+NH4NO3+3H2O
[例3]已知:
|
|
CH4 |
SiH4 |
NH3 |
PH3 |
|
沸点(K) |
101.7 |
161.2 |
239.7 |
185.4 |
|
分解温度(K) |
873 |
773 |
1073 |
713.2 |
分析上表中四种物质的相关数据,请回答:
⑴CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是____________________________。
⑵CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是________________________,结合上述数据和规律判断,一定压强下HF和HCl的混合气体降温时__________先液化。
[分析]解题时应牢牢抓住分子间作用力影响物质的物理性质,化学键的强弱影响物质的化学性质这个角度入手,由于HF分子间存在氢键,其沸点高于HCl,因此降温时HF先液化。答案为:
⑴结构相似时,相对分子质量越大,分子间作用力越大,因此SiH4沸点高于CH4;NH3分子间还存在氢键作用,因此NH3的沸点高于PH3。 ⑵C-H键键能大于Si-H键,因此CH4分解温度高于SiH4;N-H键键能大于P-H键,因此NH3分解温度高于PH3。 HF
[例4]短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
|
|
Q |
R |
|
|
T |
|
|
W |
⑴T的原子结构示意图为_______________。
⑵元素的非金属性为(原子的得电子能力):Q______W(填“强于”或“弱于”)。
⑶W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为________________________________。
⑷原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是__________________________________。
⑸R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2 L的甲气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是________________。
⑹在298 K下,Q、T的单质各1 mol完全燃烧,分别放出热量a kJ和b kJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3 mol Q的单质,则该反应在298 K下的DH = ______________(注:题中所设单质均为最稳定单质)。
[分析]本题考查无机物的性质,涉及化学用语、方程式书写、氧化还原反应以及热化学的知识。T所处的周期序数与主族序数相等,T不可能是Mg,只能是Al,继而推出Q为C,R为N,W为S。
⑵S、C最高价含氧酸为酸性是硫酸>碳酸,故非金属性S强于C。
⑶S与H2SO4发生归中反应,从元素守恒看,肯定有水生成,另外为一气体,从化合价看,只能是SO2。
⑷比R质子数多1的元素为O,存在H2O2转化为H2O的反应。
⑸N中相对分子质量最小的氧化物为NO,2NO+O2 = 2NO2,得混合物NO(1 L)-NO2(1 L),再用NaOH吸收,从氧化还原角度看,应发生归中反应:NO+NO2+2NaOH = 2NaNO3+H2O。
⑹C+O2 CO2 DH =-a kJ·mol-1①,4Al+3O2 = 2Al2O3
DH =-4b kJ·mol-1②。Al与CO2的置换反应,写出反应方程式为:4Al+3CO2
CO2 DH =-a kJ·mol-1①,4Al+3O2 = 2Al2O3
DH =-4b kJ·mol-1②。Al与CO2的置换反应,写出反应方程式为:4Al+3CO2 3C+2Al2O3,此反应的DH为可由②-①×3得,DH =-4b-(-3a) = (3a-4b) kJ·mol-1。答案为:⑴
3C+2Al2O3,此反应的DH为可由②-①×3得,DH =-4b-(-3a) = (3a-4b) kJ·mol-1。答案为:⑴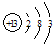 ⑵弱于。⑶S+2H2SO4(浓)
⑵弱于。⑶S+2H2SO4(浓) 3SO2↑+2H2O。⑷2H2O2
3SO2↑+2H2O。⑷2H2O2 2H2O+O2↑(或其他合理答案)。⑸NaNO2。⑹(3a-4b) kJ·mol-1
2H2O+O2↑(或其他合理答案)。⑸NaNO2。⑹(3a-4b) kJ·mol-1
[例5]金属钾的冶炼可采用如下3种方法,
方法一:KCl+Na=NaCl+K↑,方法二:2KF+CaC2=CaF2+2K↑+2C,
方法三:K2CO3+2C=2K↑+3CO↑。
试回答相关问题:
 ⑴将方法一中四种物质的熔点按由高到低的顺序排列____________________。
⑴将方法一中四种物质的熔点按由高到低的顺序排列____________________。
⑵方法二以KF和电石的主要成分(CaC2)为原料来制备K。CaC2中阴离子内部共价键的类型是____________________。产物之一CaF2的一个不完整的晶胞如右图所示,则图中实心球表示Ca2+还是F-?答: 。
⑶方法三中原料K2CO3中阴离子的空间构型为_________,与产物CO互为等电子体的离子为: (填化学式),CO在配合物中常作为配体,如近年来开始使用的一种新型汽油防震剂Fe(CO)5,该化合物中铁元素的化合价为__________。
[分析]⑴NaCl的晶格能大于KCl,因此NaCl的熔点大于KCl,金属钠中金属键强于金属钾,因此熔点Na大于K,由于碱金属的熔点均较低,可判断出两种离子化合物的熔点均高于两种金属晶体。⑵由CaC2和水反应制乙炔的反应原理可推知C22-中化学键的类型。⑶CO32-中碳原子以sp2形式杂化,因此CO32-的空间构型为平面正三角形。CO (羰基)为中性配位体,故Fe(CO)5中Fe元素为0价。答案为:
⑴NaCl>KCl>Na>K ⑵σ键和π键或答非极性共价键 Ca2+
⑶平面正三角形 CN-等 0
[专题演练]
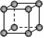
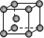
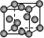
8.常见金属晶体的晶胞结构
|
典型金属 |
Po |
K |
Mg |
Cu |
|
晶胞模型 |
 |
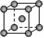 |
 |
 |
|
堆积方式 |
简单立方 |
体心立方 |
六方堆积 |
面心立方 |
|
原子配位数 |
6 |
8 |
12 |
12 |
|
晶胞中原子数 |
1 |
2 |
2 |
4 |
7.价层电子对数与分子空间构型
|
|
杂化 类型 |
VSEPR理想模型 |
键对电 子对数 |
孤对电 子对数 |
分子 类型 |
分子空 间构型 |
实例 |
|
2 |
sp |
直线形 |
2 |
0 |
AB2 |
直线形 |
BeCl2,CO2,HgCl2 |
|
3 |
sp2 |
平面三角 |
3 |
0 |
AB3 |
平面三角 |
BF3,BCl3,SO3,CO32‾,NO3‾ |
|
2 |
1 |
AB2 |
V形 |
SO2,SnCl2,NO2‾ |
|||
|
4 |
sp3 |
正四面体 |
4 |
0 |
AB4 |
正四面体 |
CH4,CHCl3,CCl4,NH4+,SO42‾,PO43‾ |
|
3 |
1 |
AB3 |
三角锥 |
NH3,NF3,SO32‾ |
|||
|
2 |
2 |
AB2 |
V形 |
H2O,SCl2,ClO2‾ |
注:判断杂化类型时一般先通过价层电子对互斥理论确定VSEPR理想模型,再判断杂化类型。
6.比较四种化学键
|
化学键 |
离子键 |
共价键 |
配位键 |
金属键 |
|
成键微粒 |
阴、阳离子 |
原子 |
原子与原子,原子与离子 |
金属阳离子与自由电子 |
|
键的强度 |
核间距越小,离子电荷数越大,离子键越强 |
键长越短,键能越大,共价键越强 |
同共价键 |
金属性越强,金属键越弱 |
|
存在 |
离子晶体 |
原子晶体或共价分子或原子团等 |
离子或多聚体分子或络合物等 |
金属晶体 |
|
实例 |
NaCl(固体) |
SiO2晶体,CO2分子内 |
NH4+,Al2Cl6 |
一般金属 |
5.元素在周期表中的位置与元素性质的关系
|
性
质 |
同周期(从左往右) |
同主族(自上而下) |
|
⑴能层数 |
相同 |
从1递增到6(或7) |
|
⑵最外层电子数 |
从1递增到8(第一周期例外) |
相同 |
|
⑶原子半径 |
减小(稀有气体除外) |
增大 |
|
⑷金属性(原子失电子能力) |
减弱 |
增强 |
|
⑸非金属性(原子得电子能力) |
增强 |
减弱 |
|
⑹电负性 |
增强 |
减弱 |
|
⑺第一电离能 |
增大 |
减小 |
|
⑻单质还原性 |
减弱 |
增强 |
|
⑼单质氧化性 |
增强 |
减弱 |
|
⑽最高价氧化物对应水化物的酸碱性 |
碱性减弱,酸性增强 |
碱性增强,酸性减弱 |
|
⑾非金属形成气态氢化物的难易程度 |
由难到易 |
由易到难 |
|
⑿气态氢化物的稳定性 |
增强 |
减弱 |
|
⒀主要化合价 |
最高正价从+1递增到+7(O、F例外),最低负价从第ⅣA族-4递增到-1 |
相同 |
|
⒁离子半径 |
r(阴离子)减小,r(阳离子)减小,r(阴离子)> r(阳离子) |
增大 |
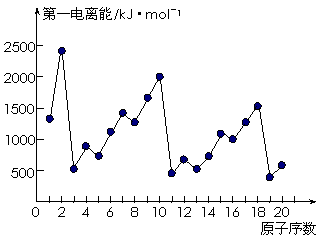
注:下图是1~20号元素第一电离能变化的曲线图。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com