
14、(18分)
(1) 。(2) 。
(3) 。
(4) .
(5) ; 。
河北灵寿中学2009--2010学年高三周练(6)
化学答卷纸
班级 姓名 考号 分数
选择题:1-5 6-10
13. (8分)
(1) , 。
(2) 。 。
12.(12分)(1)A: ,D: 。 。
(2) ,
(3) ________ 。
(4)
|
编 号 |
A |
B→C化学方程式 |
|
1 |
|
|
|
2 |
|
|
|
3 |
|
|
11.(18分)
(1)________ __;
(2)____________________; ______________________ ___________。
(3)____________ ___;
(4)___________, ____________, ________________________________。
14、(18分)化学科研小组的同学在精确测试Na2SO3溶液的pH时,遇到了困惑。为此,他们进行了冷静的思考和准备,决心重新实验,揭开奥秘。请你了解情况,参与交流讨论。
[查阅资料]①常温下0.1mol·L-1的H2SO3溶液的pH约为2.1。
②通常情况下,H2S为无色,有腐蛋臭味的气体,其水溶液称为氢硫酸。常温下0.1mol·L-1的H2S溶液的pH约为4.5。
[实验操作]①准确称取纯净的Na2SO3·7H2O晶体25.20g,配成1L水溶液,测得其pH=7.8。
②以坩埚再次准确称取25.20g上述晶体,继而隔绝空气在600℃以上高温下强热至恒重,质量为12.60g。
③将②所得之12.60g固体进行元素定性定量分析,组成与Na2SO3无异。将其溶于水得250mL溶液,测得pH=10.3。
[分析猜想] Na2SO3·7H2O在强热下失去结晶水,进而发生了分解反应(自身氧化还原反应)
[交流讨论]
(1)实验操作②中称量操作至少进行 次。
(2)给Na2SO3·7H2O加热时要隔绝空气,请以简要的文字和化学方程式给以说明。
。
(3)猜想Na2SO3在高温强热下发生分解反应的化学方程式是 。
(4)实验①和③中,两次测得的溶液pH相差明显,其合理的解释是
。实验③中溶液的pH=10.3的原理是(以相关的离子方程式表示) 。
(5)请你设计简单的实验方案,给上述分析、猜想及解释以佐证。请简单叙述实验步骤、现象和结论。 。
13.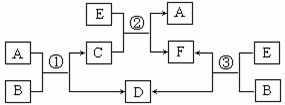 (12分)A、B、C、D、E、F六种物质在一定条件下有如图所示的相互转化关系,所有反应物和生成物已给出。
(12分)A、B、C、D、E、F六种物质在一定条件下有如图所示的相互转化关系,所有反应物和生成物已给出。
(1)若反应①、②、③均为溶液中的置换反应,且通常状况下A为液态非金属单质,B的焰色反应为黄色,则根据反应①、②、③比较相关物质的氧化性由强到弱的顺序为 (用字母表示);反应②的离子方程式为
。
(2)若B是一种淡黄色固体,绿色植物的光合作用和呼吸作用可实现自然界中D、E的循环,则反应①的离子方程式为 。在反应③中若生成1molD,则转移的电子数目为
12.(12分)A、B、C、D均为中学所学的常见物质且均含有同一种元素,它们之间的转化关系如下图所示(反应条件及其他物质已经略去):
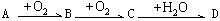 。
。
(1)若A、D的水溶液均能使湿润的蓝色石蕊试纸变红,则A、D分别为(填写化学式)A: ,D: 。写出A→B转化的化学方程式: 。
(2)若A的水溶液能使湿润的红色石蕊试纸变蓝,D的稀溶液能使蓝色的湿润石蕊试纸变红。则A为 ,写出A→B转化的化学方程式: 。
(3)若A为周期表中短周期元素形成的单质,D为强碱,则出C的电子式 。
(4)若A为短周期元素形成的非金属单质,则A有多种情况,请填写下表,并完成相应的化学反应方程式。(可以不填满,也可以补充)
|
编 号 |
A |
B→C化学方程式 |
|
1 |
|
|
|
2 |
|
|
|
3 |
|
|
11.(18分)下表是短周期中部分元素的原子半径及主要化合价。请回答:
|
元素代号 |
U |
V |
W |
X |
Y |
Z |
M |
|
原子半径/nm |
0.037 |
0.157 |
0.074 |
0.075 |
0.077 |
0.143 |
0.102 |
|
主要化合价 |
+1 |
+1 |
-2 |
-3,+5 |
+2,+4 |
+3 |
-2,+6 |
(1)X在元素周期表中的位置是__________;
(2)V、W、Z三种元素的离子具有相同的电子层结构,三者的离子半径由大到小顺(用离
子符号表示)是____________________;并用离子方程式表示出Z离子可作净水剂的原因___________________________ ______。
(3)M的单质能跟V的最高价氧化物水化物的热浓溶液发生氧化还原反应,生成的两种正
盐的水溶液均呈碱性,写出该氧化还原反应的离子方程式____________ ___;
(4)W、X、Y分别与U均可形成10电子共价化合物,晶体类型均为___________,其中,
属于非极性分子的是(写化学式)____________,若将其作为燃料,以熔融的K2CO3
为电解质,空气作为氧化剂,并选择适当的隋性电极,组成原电池。写出该电池工作
时的负极反应式_____________________________ ___。
10、已知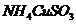 与足量的10mol/L硫酸液混合微热,产生下列现象:①有红色金属生成 ②产生刺激性气味的气体 ③溶液呈现蓝色。据此判断下列说法正确的是(
)
与足量的10mol/L硫酸液混合微热,产生下列现象:①有红色金属生成 ②产生刺激性气味的气体 ③溶液呈现蓝色。据此判断下列说法正确的是(
)
A、反应中硫酸作氧化剂
B、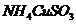 中硫元素被氧化
中硫元素被氧化
C、刺激性气味的气体是氨气 D、1mol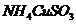 完全反应转移0.5mol电子
完全反应转移0.5mol电子
9、右表是元素周期表的一部分。X、Y、Z、W均为短周期元素,X、W的质子数之和为23。
下列说法正确的是( )
|
|
X |
|
Y |
|
Z |
|
W |
|
A.X元素最多可形成五种氧化物 B.W元素的非金属性比Z元素非金属性弱
C.Z和X能以共价键结合形成一种无机非金属材料
D.Y元素的最高价氧化物的水化物是含氧酸中酸性最强的
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com