
1.由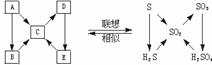 、
、
3.氢氧化亚铁的制备方法
因Fe(OH)2在空气中易氧化,4Fe(OH)2+O2+2H2O==4Fe(OH)3,故Fe(OH)2在水中稳定存在的寿命只有几秒钟,在实验室制取Fe(OH)2时,一定要用新制的Fe2+盐和先加热驱赶O2后的NaOH溶液,且滴管末端插入试管内的液面下,再滴加NaOH溶液,也可以在反应液面上滴加植物油或苯等物质进行液封,以减少Fe(OH)2与O2接触。
关于Fe(OH)2制备的方法很多,核心问题两点,一是溶液中的溶解氧必须除去,二是反应过程必须与O2隔绝。
2.Fe2+与Fe3+的鉴别
⑴直接观察颜色:Fe2+的溶液呈浅绿色,Fe3+的溶液呈棕黄色。
⑵利用显色反应:
① ,有关离子方程式:Fe3++SCN-==[Fe(SCN)]2+
,有关离子方程式:Fe3++SCN-==[Fe(SCN)]2+
②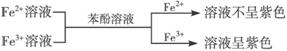
⑶利用铁化合物沉淀的颜色:
①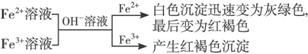
有关反应式:Fe2++2OH-=Fe(OH)2↓,4Fe(OH)2+2H2O+O2=4Fe(OH)3。Fe3++3OH-==Fe(OH)3↓。
②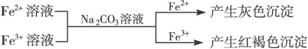
有关离子反应式:2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑
⑷利用Fe3+的氧化性:
①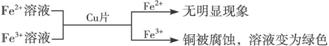 ,有关离子反应式:2Fe3++Cu==2Fe2++Cu2+
,有关离子反应式:2Fe3++Cu==2Fe2++Cu2+
②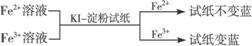 ,有关离子反应式:2Fe3++2I-==2Fe2++I2
,有关离子反应式:2Fe3++2I-==2Fe2++I2
③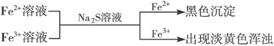 ,有关离子反应式:Fe2++S2-==FeS↓,Fe3++S2-=2Fe2++S↓
,有关离子反应式:Fe2++S2-==FeS↓,Fe3++S2-=2Fe2++S↓
⑸利用Fe2+的还原性:
①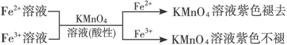 ,
,
有关离子反应式:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
②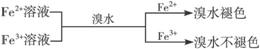 ,有关离子反应式:2Fe2++Br2==2Fe3++2Br-
,有关离子反应式:2Fe2++Br2==2Fe3++2Br-
注:以上方法以KSCN溶液鉴别最常用。
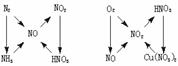
1.以铁、铜为中心的转化关系

2.铝三角之间的转换及其图像
在Al3+、Al(OH)3、AlO2-之间的相互转化反应中,都有特定的数量关系。其中的定量关系可用数学中数形结合的思想加以分析,现概括如下:
⑴在适量的可溶性铝盐溶液中逐滴加入NaOH溶液至过量:
现象:立即产生白色沉淀→渐多→最多(n(NaOH)∶n(Al3+)=3∶1)→渐少→消失(n(NaOH)∶n(Al3+)=4∶1),见下图⑴。
⑵在适量的偏铝酸盐溶液中逐滴加入稀盐酸至过量:
现象:立即产生白色沉淀→渐多→最多(n(H+)∶n(AlO2-)=1∶1)→渐少→消失(n(H+)∶n(AlO2-)=4∶1),见下图⑵。
⑶在适量的偏铝酸盐溶液中缓慢通入CO2至过量:现象:立即产生白色沉淀→渐多→最多(n(CO2)∶n(AlO2-)=1∶2)→沉淀不消失。见下图⑶。
⑷在适量强碱性溶液中逐滴加入铝盐溶液至过量:
现象:局部产生白色沉淀→振荡消失→白色沉淀→渐多→最多(n(OH)-∶n(Al3+)=(3∶1)→不消失。见下图⑷。
⑸在适量强酸性溶液中逐滴加入偏铝酸盐溶液至过量
现象:局部产生白色沉淀→振荡消失→白色沉淀→渐多→最多。见下图⑸。
1.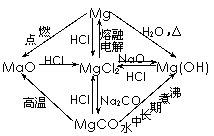
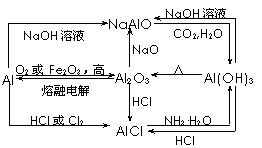 以Al2O3、MgCl2为中心的转化关系图
以Al2O3、MgCl2为中心的转化关系图
3.焰色反应
⑴概念:多种金属或它们的化合物在燃烧时使火焰呈特殊的颜色,这在化学上叫焰色反应,该反应属物理变化。
⑵用品:铂丝(或铁、铬、镍、钨等)、酒精灯(或煤气灯)、试剂。
⑶操作:进行焰色反应的操作,应把装在玻璃棒上的铂丝放在酒精灯火焰里灼烧,等到与原来火焰颜色相同的时候,蘸上要检验的溶液,放在火焰上观察火焰的颜色。观察钾的火焰颜色的时候,要透过蓝色的钴玻璃片去观察,这样可以滤去黄色的光,避免其中钠元素杂质所造成的干扰。
2.碱金属的性质规律与特例
⑴通常合金多呈固态,而钠钾合金却是液态。
⑵碱金属单质在空气或氧气中燃烧时,生成过氧化物甚至比过氧化物更复杂的氧化物,而Li只生成Li2O。
⑶碱金属单质密度一般随核电荷数增大而递增,但K的密度比Na小。
⑷碱金属单质一般跟水剧烈反应,但Li跟水反应缓慢(LiOH溶解度小)。
⑸碱金属单质因其活动性强,多保存在煤油中,而Li却因密度比煤油更小,只能保存在液体石蜡中。
⑹碱金属的盐一般都易溶于水,但Li2CO3却微溶。
⑺一般说,酸式盐较正盐溶解度大,但NaHCO3却比Na2CO3溶解度小。
⑻Fr是放射性元素,所以在自然界中不存在。
1.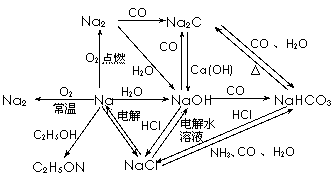 以Na为中心的转化关系图
以Na为中心的转化关系图
2.硅及其化合物的特殊性
⑴硅的还原性比碳强,而碳在高温下能从二氧化硅中还原出硅。
⑵非金属单质与强碱溶液反应一般不生成氢气,而硅与氢氧化钠等强碱溶液反应产生氢气。
⑶非金属单质一般不与非氧化性酸反应,而硅不但与氢氟酸反应,而且有氢气生成。
⑷酸性氧化物一般不与酸发生复分解反应,而二氧化硅却能与氢氟酸反应,生成四氟化硅和水。
⑸无机酸一般易溶于水,而硅酸和原硅酸却难溶于水。
⑹在水溶液中,碳酸的酸性比硅酸强,二氧化碳与硅酸钠反应生成碳酸钠和硅酸沉淀。在高温下碳酸钠与二氧化硅反应生成硅酸钠和二氧化碳,其原因是在高温条件下,生成的二氧化碳离开反应体系而使反应进行到底。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com