
1.设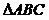 的三内角A、B、C成等差数列,sinA=
的三内角A、B、C成等差数列,sinA=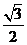 ,则这个三角形的形状是( )
,则这个三角形的形状是( )
A.直角三角形 B钝角三角形 C.等腰直角三角形 D.等边三角形
31.(6分)某课外小组通过下列实验测定某试样Ba(OH)2·nH2O中的n值,并用氢氧化钡溶液确定pH=3的一元弱酸HA发生电离的百分率。
(1)称取3.15 g试样溶于蒸馏水配成100 mL溶液,从中取出10.00 mL溶液于锥形瓶中,加2滴指示剂,用0.100 mol / L HCl标准溶液滴定至终点,共消耗标准液20.00 mL,求试样中氢氧化钡的物质的量。
(2)另取3.15g试样加热至失去全部结晶水,称得质量为1.71g,求试样Ba(OH)2·nH2O中的n值。
(3)用上述(1)中的氢氧化钡溶液滴定pH=3的一元弱酸HA的溶液25.00 mL,达到终点时消耗该氢氧化钡溶液12. 50 mL。求一元弱酸HA发生电离的百分率。
高新第一中学09-10学年高二上学期十月月考
30.(6分)t℃时,纯水的KW=1×10-13。计算:
(1)该温度下0.005mol/L的H2SO4溶液中:①C(H+) = mol/L ②C(OH-)= mol/L
③由水电离出的H+浓度= mol/L。
(2)该温度下将0.005mol/L的H2SO4溶液和0.03mol/L的NaOH溶液按体积比为1:1混合,求混合后溶液的PH(写出计算过程)。
29.(4分)只限使用下列试剂:酚酞溶液、石蕊试液、稀氨水、氯化铵晶体、浓盐酸、熟石灰粉末、醋酸铵晶体和蒸馏水。根据①弱碱在水中存在电离平衡②弱碱的阳离子会破坏水的电离平衡。这两种平衡移动均会引起指示剂颜色变化。由此可分别选用上述试剂,设计两个实验证明NH3·H2O是弱碱。请简述实验方法及现象。(已知:醋酸铵溶液呈中性)
(1)应用根据①的实验方法及现象____________________________________________。
(2)应用根据②的实验方法及现象____________________________________________。
28.(11分)某学生为测定未知盐酸溶液的浓度,将1.00mL待测盐酸配制成100mL稀盐酸溶液;以0.14mol·L-1的NaOH溶液滴定上述稀盐酸25.00mL,滴定终点时消耗NaOH溶液15.00mL。该学生用标准0.14mol·L-1 NaOH溶液滴定稀盐酸的实验操作如下:
A、用酸式滴定管取稀盐酸25.00mL,注入锥形瓶中,加入两滴酚酞
B、用稀盐酸溶液润洗酸式滴定管
C、用蒸馏水洗干净滴定管
D、取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2-3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
E、检查滴定管是否漏水
F、另取锥形瓶,再重复操作一次
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
(1)滴定操作的正确顺序是(用序号填写)E→ →D→ → → →F。
(2)碱式滴定管用蒸馏水润洗后,未用标准NaOH溶液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”) 。
(3)在G操作中如何确定终点? 。
(4)如有1mol/L和0.1mol/L的NaOH溶液,应选用 的NaOH溶液,原因是 。
(5)用标准NaOH溶液滴定时,应将标准NaOH溶液注入滴定管 (选填“甲”或“乙”)中。
(6)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则会导致测得的稀盐酸溶液浓度值 (选填“偏大”“偏小”或“无影响”)。
(7)待测盐酸溶液(稀释前的盐酸溶液)的物质的量浓度为 mol/L(计算结果到小数点后二位)。
27.(11分)已知某溶液中只存在OH-、H+、Na+、CH3COO-四种离子:
(1)若溶液中只溶解了一种溶质,该溶质是 (填化学式),上述离子浓度由小到大的顺序是 (填离子的浓度符号顺序)。
(2)若溶液中两种离子浓度关系为c(Na+) =c(CH3COO-),则该溶液显 性(填“酸”、“中”、“碱”)。 该溶液中的溶质可能是 (填化学式)。
(3)若该溶液由体积相等的醋酸和氢氧化钠溶液混合而成,混合后溶液呈酸性,则混合前溶液中的c(CH3COOH)
c(NaOH)(填>或=或<)。该溶液中存在的三个平衡体系是H2O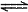 H++OH-、_________________________和__________________________(用离子方程式表示)。
H++OH-、_________________________和__________________________(用离子方程式表示)。
(4)25℃时,将pH=a的醋酸VamL和pH=14-a的氢氧化钠溶液VbmL混合,若溶液显碱性,则Va Vb(填>或=或<)。
26.(10分) (1)氯化铝水溶液呈 性(填“酸”、“中”、“碱”),常温时pH 7
(填>或=或<),原因是(用离子方程式表示) 。实验室配制氯化铝溶液时,为了抑制水解,可以加入少量的 。把氯化铝溶液蒸干,灼烧,最后得到的主要固体产物是 。
(2)硫化钠水溶液中:①C(Na+) 2C(S2-)(填>或=或<,下同)② C(H+) C(OH-),原因是(用离子方程式表示) 。
25.(4分)(1)将等质量的Zn粉分别投入10mL 0.1mol·L-1 盐酸a和10mL 0.1mol·L-1醋酸b中: ①若Zn不足量,则反应速率a b(填>或=或<, 下同);②若Zn过量,产生H2的量a b。
(2)将等质量Zn粉分别投入PH=1,体积均为10mL的盐酸a和醋酸b中: ①若Zn不足量,则反应速率a b(填>或=或<, 下同);②若Zn过量,产生H2的量a b。
24. 25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的PH=7时,下列关系正确的是
A.c(NH4+)==c(SO42-) B.c(NH4+)>c(SO42-)
C.c(NH4+)<c(SO42-) D.c(OH-)+c(SO42-)==c(H+)+c(NH4+)
23.某酸碱指示剂(HIn)在水溶液中存在以下平衡:
HIn(aq)
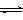 H+ +
In-(aq)
H+ +
In-(aq)
(红色) (蓝色)
下列物质的溶液中,能使指示剂显蓝色的是
A.稀硫酸 B.氯化铝溶液 C.稀氨水 D.饱和食盐水
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com