
19.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+) ( ) A.阳极发生还原反应,其电极反应式:Ni2++2e-=Ni B.电解过程中,阳极质量的减少与阴极质量的增加相等 C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+ D.电解后,电解槽底部的阳极泥中只有Cu和Pt
18.下图中能验证氯化钠溶液(含酚酞)电解产物的装置是 ( )
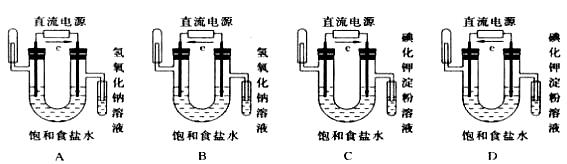
17.下列离子方程式书写正确的是
A.硫酸氢钠溶液中加入氢氧化钡溶液至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O
B.过量二氧化碳通入偏铝酸钠溶液中:CO2+2H2O+AlO2-==Al(OH)3↓+HCO3-
C.漂白粉溶液中通入少量SO2气体:Ca2+ + 2ClO- + SO2 + H2O = CaSO3↓+2HClO
D.向NH4HCO4溶液中过量的NaOH溶液反应:
OH- + NH4+ = NH3·H2O
16.在氧气中灼烧0.44g硫和铁组成的化合物,使其中的硫全部转变为二氧化硫, 把这些二氧化硫全部氧化并转变为硫酸.这些硫酸可以用20.00mL0.50mol/L氢氧化钠溶液完全中和.则原化合物中硫的质量分数为
A.18% B.46% C.53% D.36%
15.下面是某加碘食盐包装袋上的部分图表文字(I为碘元素符号)。由此,你得到的信息和作出的推测是
 |
|||
|
A.人体不能缺碘,需要正常补碘。“加碘食盐”中的“碘”是指碘单质
B.该食盐商品是以海盐为原料,经人加工后的产品,是盐类的纯净物
C.1kg此食盐中含碘酸钾(35±15)mg
D.“菜未烧熟不宜加入加碘盐”的原因可能是碘酸钾受热不稳定
14.下列实验现象描述正确的是
A.碘水中加入少量汽油振荡,静置后上层颜色变浅,下层颜色变为紫红色
B.红热的铜丝在氯气中燃烧,产生了棕黄色的烟雾
C.电解氯化钠饱和溶液,将阴极气体产物通入碘化钾淀粉溶液中,溶液变蓝
D.溴化钠溶液中加入少量新制的氯水振荡,再加入少量四氯化碳振荡,静置后上层颜
色变浅,下层颜色变为橙红色
13.自来水可以用氯气消毒。某学生用这种自来水去配制下列物质的溶液,不会产生明显的
变质问题的是
A、硝酸银 B、氯化亚铁 C、亚硫酸钠 D、氯化铝
12.(08年海南化学·8)白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P-P a kJ·mol-1、P-O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。
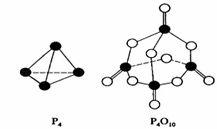
根据图示的分子结构和有关数据估算该反应的△H,其中正确的是
A.(6a+5d-4c-12b)kJ·mol-1 B(4c+12b-6a-5d)kJ·mol-1
C.(4c+12b-4a-5d)kJ·mol-1
D.(4a+5d-4c-12b)kJ·mol-1
11. 对于密闭容器中的反应:N2(g)+3H2(g)
对于密闭容器中的反应:N2(g)+3H2(g) 2NH3(g);
2NH3(g);
△H <0,在673K,30MPa下n(NH3)和n(H2)随时间变
化的关系如图所示。下列叙述正确的是 ( )
A.点a处的正反应速率比点b处的大
B.点 c处的正反应速率比逆反应速率大
C.点d (t1时刻) 的n(N2)比点 e (t2时刻) 处的n(N2)大
D.其他条件不变,773K下反应至t1时刻,此时画出的两根平行线间的距离将要变大
10. MnO2和Zn是制造干电池的重要原料,工业上用软锰矿和闪锌矿联合生产MnO2和Zn的基本步骤为:( )
⑴ 软锰矿、闪锌矿与硫酸共热: MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O。
 ⑵ 除去反应混合物中的不溶物
⑵ 除去反应混合物中的不溶物
⑶ 电解混合液MnSO4+ZnSO4+2H2O MnO2+Zn+2H2SO4
下列说法不正确的是 ( )
A.步骤⑴中MnO2和H2SO4都是氧化剂
B.步骤⑴中每析出12.8g S沉淀共转移0.8mol电子
C.电解时MnO2在阴极处产生
D.硫酸在生产中可循环使用
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com